-
下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是
物质(括号内为杂质)
除杂试剂
A
FeCl2溶液(FeCl3)
Fe粉
B
NaCl溶液(MgCl2)
NaOH溶液、稀HCl
C
Cl2(HCl)
H2O、浓H2SO4
D
NO(NO2)
H2O、无水CaCl2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列能量转化过程与氧化还原反应无关的是
A. 硅太阳能电池工作时,光能转化成电能
B. 锂离子电池放电时,化学能转化成电能
C. 电解质溶液导电时,电能转化成化学能
D. 葡萄糖为人类生命活动提供能量时,化学能转化成热能
难度: 中等查看答案及解析
-
室温下,取20 mL 0.1 mol·L−1某二元酸H2A,滴加0.2 mol·L−1 NaOH溶液。已知:H2AH++HA−,HA−⇌H++A2−。下列说法不正确的是
A. 0.1 mol·L−1 H2A溶液中有c(H+)-c(OH−)-c(A2−)=0.1 mol·L−1
B. 当滴加至中性时,溶液中c(Na+)=c(HA−)+2c(A2−),用去NaOH溶液的体积小于10 mL
C. 当用去NaOH溶液体积10 mL时,溶液的pH<7,此时溶液中有c(A2−)=c(H+)-c(OH−)
D. 当用去NaOH溶液体积20 mL时,此时溶液中有c(Na+)=2c(HA−)+2c(A2−)
难度: 困难查看答案及解析
-
化学与生活密切相关。下列叙述错误的是
A. 高纯硅可用于制作光感电池
B. 铝合金大量用于高铁建设
C. 活性炭具有除异味和杀菌作用
D. 碘酒可用于皮肤外用消毒
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A.NH4HCO3受热易分解,可用作化肥
B.稀硫酸具有酸性,可用于除去铁锈
C.SO2具有氧化性,可用于纸浆漂白
D.Al2O3具有两性,可用于电解冶炼铝
难度: 简单查看答案及解析
-
化学在人类社会发展中发挥着重要作用,下列事实不涉及化学反应的是( )
A. 利用废弃的秸秆生产生物质燃料乙醇
B. 利用石油生产塑料、化纤等高分子材料
C. 利用基本的化学原料生产化学合成药物
D. 利用反渗透膜从海水中分离出淡水
难度: 简单查看答案及解析
-
陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是
A. “雨过天晴云破处”所描述的瓷器青色,来自氧化铁
B. 闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成
C. 陶瓷是应用较早的人造材料,主要化学成分是硅酸盐
D. 陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
难度: 简单查看答案及解析
-
反应NH4Cl+NaNO2
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:
B. N2的结构式:N=N
C. Na+的结构示意图:
D. H2O的电子式:
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A.NaCl(aq)
Cl2(g)
FeCl2(s)
B.MgCl2(aq)
Mg(OH)2(s)
MgO (s)
C.S(s)
SO3(g)
H2SO4(aq)
D.N2(g)
NH3(g)
Na2CO3(s)
难度: 中等查看答案及解析
-
下列说法正确的是
A. 氢氧燃料电池放电时化学能全部转化为电能
B. 反应4Fe(s)+3O2(g)
2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C. 3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
难度: 中等查看答案及解析
-
下列说法中正确的是
A.PCl3 分子呈三角锥型,这是 P 原子以 sp2 杂化的结果
B.sp3 杂化轨道是由任意的 1 个 s 轨道和 3 个 p 轨道混合形成的 4 个 sp3 杂化轨道
C.中心原子采取 sp3 杂化的分子,其几何构型不一定都是四面体
D.AB3 型的分子空间构型必为平面三角形
难度: 中等查看答案及解析
-
下列描述正确的是( )
A.CS2为V形极性分子
B.SiF4与SO32-的中心原子均为sp3杂化
C.C2H2分子中σ键与π键的数目比为1∶1
D.水加热到很高温度都难分解是因水分子间存在氢键
难度: 简单查看答案及解析
-
今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
A.原子半径:W<X
B.常温常压下,Y单质为固态
C.气态氢化物热稳定性:Z<W
D.X的最高价氧化物的水化物是强碱
难度: 中等查看答案及解析
-
通过以下反应可获得新型能源二甲醚(
)。下列说法不正确的是
①
②
③
④
A.反应①、②为反应③提供原料气
B.反应③也是
资源化利用的方法之一
C.反应
的
D.反应
的
难度: 中等查看答案及解析
-
为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D−Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D−Zn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)
ZnO(s)+2Ni(OH)2(s)。以下说法不正确的是
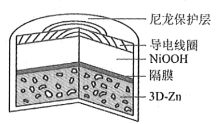
A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH−(aq)−e−
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH−(aq)−2e−
ZnO(s)+H2O(l)
D. 放电过程中OH−通过隔膜从负极区移向正极区
难度: 困难查看答案及解析
-
室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
难度: 中等查看答案及解析
-
NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10−3 ,Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
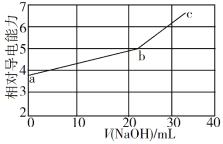
A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2−的导电能力之和大于HA−的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH−)
难度: 中等查看答案及解析
-
化合物 Y 能用于高性能光学树脂的合成,可由化合物 X 与 2 −甲基丙烯酰氯在一定条件下反应制得:

下列有关化合物 X、Y 的说法正确的是
A.X 分子中所有原子一定在同一平面上
B.Y 与 Br2 的加成产物分子中含有手性碳原子
C.X、Y 均不能使酸性 KMnO4 溶液褪色
D.X→Y 的反应为氧化反应
难度: 中等查看答案及解析
-
实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A.向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B.实验中装置b中的液体逐渐变为浅红色
C.装置c中的碳酸钠溶液的作用是吸收溴化氢
D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
难度: 中等查看答案及解析
-
工业上采用湿法炼锌过程中,以ZnSO4为主要成分的浸出液中,含有Fe3+、Fe2+、Cu2+、Cl-等杂质,这些杂质不利于锌的电解,必须事先除去。
现有下列试剂可供选择:①酸性KMnO4溶液 ②NaOH溶液 ③ZnO ④H2O2溶液 ⑤Zn ⑥Fe ⑦AgNO3 ⑧Ag2SO4
下列说法不正确的是
A. 用酸性KMnO4溶液将Fe2+氧化成Fe3+,再转化为Fe(OH)3沉淀除去
B. 用ZnO调节浸出液的酸碱性,可使某些离子形成氢氧化物沉淀
C. 在实际生产过程中,加入Ag2SO4可除去Cl-,利用的是沉淀转化的原理
D. 可以用ZnCO3代替ZnO调节溶液的酸碱性
难度: 中等查看答案及解析
-
莎普爱思的有效成分是由苄达酸与赖氨酸生成的有机盐,苄达酸结构如图所示。下列关于苄达酸的叙述正确的是( )
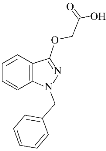
A.分子式为C16H16N2O3
B.属于芳香族化合物,且有弱酸性
C.苯环上的一氯代物有5种
D.所有原子可能共平面
难度: 中等查看答案及解析
-
为了强化安全管理,某油库引进一台测空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液)。下列说法不正确的是
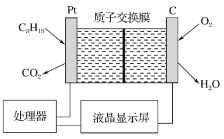
A.石墨电极作正极,发生还原反应
B.铂电极的电极反应式:C8H18+16H2O-50e-===8CO2↑+50H+
C.H+由质子交换膜左侧向右侧迁移
D.每消耗 5.6 L O2,电路中通过 1 mol 电子
难度: 中等查看答案及解析
-
常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积的n倍。稀释过程中,两溶液pH的变化如下图所示。下列叙述正确的是
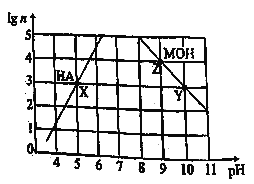
A.MOH为弱碱,HA为强酸
B.水的电离程度:X=Z>Y
C.若升高温度,Y、Z点对应溶液的pH均不变
D.将X点溶液与Z点溶液等体积混合,所得溶液呈碱性
难度: 困难查看答案及解析
-
常温下,向 20 mL 0.1 mol·L-1(NH4)2SO4 溶液中逐滴加入 0.2 mol·L-1NaOH 溶液时,溶液的 pH与所加 NaOH 溶液体积的关系如图所示(不考虑挥发)。下列说法正确的是
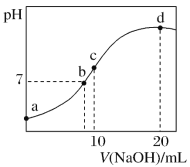
A.点 a 所示溶液中:c(NH
)>c(SO
)>c(OH-)>c(H+)
B.点 b 所示溶液中:c(NH
)=c(Na+)>c(H+)=c(OH−)
C.点 c 所示溶液中:c(SO
)+c(H+)=c(NH3·H2O)+c(OH−)
D.点 d 所示溶液中:c(SO
)>c(NH3·H2O)>c(OH-)>c(NH
)
难度: 中等查看答案及解析
-
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)
2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:
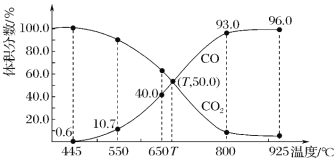
已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是
A.650 ℃时,反应达平衡后 CO2 的转化率为 25.0%
B.550 ℃时,若充入惰性气体,v(正)、v(逆)均减小,平衡不移动
C.T ℃时,若充入等体积的 CO2 和 CO,平衡向正反应方向移动
D.925 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数 Kp=24.0p总
难度: 中等查看答案及解析
-
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫等危害。在2L恒容密闭容器中一定条件下发生反应:CO(g)+H2S(g)
COS(g)+H2(g);起始 CO 物质的量为 10 mol,10 min 达平衡,CO 物质的量变为 8 mol,此条件下该反应的平衡常数 K = 0.1。下列说法不正确的是
A.升高温度,H2S 浓度增加,表明该反应是放热反应
B.10 min 内平均速率:v(COS)=0.1 mol·L-1·min-1
C.反应前 H2S 物质的量为 5 mol
D.CO 的平衡转化率为 20%
难度: 中等查看答案及解析
-
NO2、O2 和熔融 KNO3 可作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物 Y,Y 可循环使用。下列说法正确的是
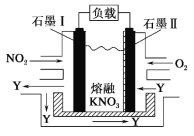
A.放电时,NO
向石墨Ⅱ电极迁移
B.电池总反应式为 4NO2+O2===2N2O5
C.石墨Ⅱ附近发生的反应为 NO+O2+e- ===NO
D.当外电路通过 4 mol e-,负极上共产生 2 mol N2O5
难度: 中等查看答案及解析
-
某温度下,在甲、乙、丙、丁四个恒容密闭容器中通入 H2 和 I2,发生反应:H2(g)+I2(g)
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器
起始浓度
平衡浓度
c(H2)/mol∙L-1
c(I2)/mol∙L-1
c(HI)/mol∙L-1
甲
0.01
0.01
0.004
乙
0.01
0.02
a
丙
0.02
0.01
b
丁
0.02
0.02
—
下列判断正确的是
A.HI 的平衡浓度:a=b>0.004
B.平衡时,H2 的平衡转化率:丁>甲
C.平衡时,乙中 H2 的平衡转化率等于 20%
D.丙中条件下,该反应的平衡常数 K=4
难度: 中等查看答案及解析
-
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH
、Cl-、Mg2+、Ba2+、CO
、SO
,现取三份 100 mL 溶液进行如下实验:
(1)第一份加足量 NaOH 溶液加热后,收集到气体 0.04 mol。
(2)第二份加足量 BaCl2 溶液后,得干燥沉淀 6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为 2.33 g。
(3)第三份加入 AgNO3 溶液有沉淀产生。根据上述实验,以下推测不正确的是
A.100 mL 溶液中含 0.04 mol NH
B.100 mL 溶液中含 0.01 mol SO42-和 0.02 mol CO32-
C.K+、Cl-可能存在
D.一定不存在Ba2+、Mg2+
难度: 中等查看答案及解析
-
某废水中含有 Cr2O72-,为了处理有毒的 Cr2O72-,需要先测定其浓度:取 20 mL 废水,加入适量稀硫酸, 再加入过量的 V1 mL c1 mol·L-1(NH4)2Fe(SO4)2 溶液,充分反应(还原产物为 Cr3+)。用 c2 mol·L-1KMnO4 溶液滴定过量的 Fe2+至终点,消耗 KMnO4 溶液 V2 mL。则原废水中 c(Cr2O72-)为(用代数式表示)
A.
mol·L-1
B.
mol·L-1
C.
mol·L-1
D.
mol·L-1
难度: 中等查看答案及解析

 (R、R′代表烃基)
(R、R′代表烃基)