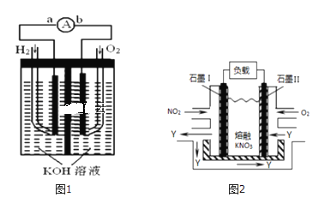
-
化学与社会、生产、生活皆有着密切联系。下列有关说法正确的是
A.用纯碱和用洗洁精都能洗涤玻璃仪器表面的油污,二者去污原理相同
B.温室大棚中使用的“吊挂式二氧化碳气肥”的主要成分可以是碳酸钙
C.合理利用太阳能、风能和氢能等能源有利于实现“低碳经济”
D.马口铁(又名镀锡铁)表面镀层破损后仍有较好的抗腐蚀性
难度: 中等查看答案及解析
-
下列过程需要通电后才可以发生或进行的是
①电离 ②电泳 ③电解 ④电镀 ⑤电化学腐蚀
A.①② B.②③④ C.①③④⑤ D.全部
难度: 中等查看答案及解析
-
常温下,下列溶液中c(H+)最小的是
A.pH=0的溶液 B.0.03 mol·L-1H2SO4
C.0.05 mol·L-1HClO D.0.05 mol·L-1的NaHSO4
难度: 中等查看答案及解析
-
下列措施对增大反应速率明显有效的是
A.食品、蔬菜贮存在冰箱或冰柜里
B.Zn与25%的稀硫酸反应制取H2时,改用98%的浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.将炭块磨成炭粉用于燃烧
难度: 简单查看答案及解析
-
下列方程式书写正确的是
A.HCO3-在水溶液中的电离方程式:HCO3-+H2O
H3O++CO32-
B.乙烷燃烧热的热化学方程式:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-2319.6 kJ/mol
C.CO32-的水解方程式:CO32-+2H2O
H2CO3+2OH-
D.CaCO3的溶解方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
难度: 中等查看答案及解析
-
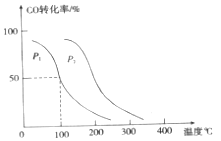
工业上由CO2和H2合成气态甲醇的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-50kJ·mol-1。下面表示合成甲醇的反应的能量变化示意图,其中正确的是( )
A.
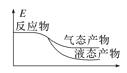 B.
B. 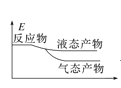
C.
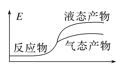 D.
D. 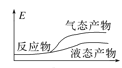
难度: 简单查看答案及解析
-
下列应用与盐类的水解无关的是
A.明矾净水
B.FeSO4溶液保存时加入少量铁粉
C.草木灰不可以和铵态氮肥混用
D.FeCl3饱和溶液滴入沸水中制备Fe(OH)3胶体
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.反应2HI(g)
H2(g)+I2(g) 达平衡后,缩小反应容器体积,混合气体颜色变深
C.合成氨工厂通常采用20 MPa~50 MPa压强,以提高原料的利用率
D.用HCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失
难度: 中等查看答案及解析
-
在恒容密闭容器中加入浓度均为0.2 mol·L−1的CO和H2O, T℃发生如下反应:CO(g)+H2O(g)
CO2(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是
A.单位时间内消耗1 mol CO同时生成1 mol CO2
B.混合气体的密度不再变化
C.CO、H2O、CO2和H2 的浓度不再变化
D.混合气体的平均摩尔质量不再变化
难度: 中等查看答案及解析
-
下列说法不正确的是
A.电冶金时,电解熔融氯化铝制取金属铝
B.电镀时,将镀层金属与电源正极相连
C.二次电池充电时,发生电解反应;放电时,发生原电池反应
D.将钢闸门与外加直流电源的负极相连,可防止其被腐蚀
难度: 中等查看答案及解析
-
下列说法中有明显错误的是
A.对于气体反应来说,增大压强(减小容器体积),可使单位体积内活化分子数增加,因而反应速率加快
B.活化分子之间发生的碰撞不一定为有效碰撞
C.升高温度,一般可使活化分子的百分数增大,因而反应速率加快
D.加入适宜的催化剂,可使分子获得更高的能量,从而提高活化分子的百分数,反应速率增大
难度: 中等查看答案及解析
-
一定能在下列溶液中大量共存的离子组是( )
A.水电离产生的H+浓度为1×10-12mol·L-1的溶液:NH4+、Na+、Cl-、HCO3-
B.能使pH试纸变深蓝色的溶液:Na+、AlO2-、S2-、O32-
C.含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D.pH=1的水溶液中:Al3+、NH4+、CH3COO-、Br-
难度: 困难查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性小于碳酸
B
将MgCl2溶液加热蒸干,得到白色固体
固体为MgCl2
C
向某溶液中滴加K3[Fe(CN)6]溶液,产生蓝色沉淀
原溶液中有Fe2+
D
向盛有1 mL 2 mol/L NaOH溶液的试管中滴入几滴0.1 mol/L MgCl2溶液,有白色沉淀生成;再加入几滴0.1 mol/L FeCl3溶液,有红褐色沉淀生成
Ksp[Mg(OH)2] >Ksp[Fe(OH)3]
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++ OH-;ΔH > 0 ,下列叙述正确的是
A.向水中加人稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加人少量固体CH3COONa ,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
难度: 中等查看答案及解析
-
下列说法正确的是
A.只有难溶电解质才存在溶解平衡
B.溶度积Ksp与温度有关,温度越高,溶度积越大
C.难溶电解质的溶度积Ksp越小,则它的溶解度越小
D.向Ca(OH)2悬浊液中加入少量CaO粉末,溶液中n(Ca2+)减少
难度: 中等查看答案及解析
-
比亚迪公司开发了锂钒氧化物二次电池。电池总反应为V2O5+xLi
LixV2O5,下列说法正确的是
A.该电池充电时,锂电极与外加电源的负极相连
B.该电池放电时,Li+向负极移动
C.该电池充电时,阴极的反应为LixV2O5-xe-=V2O5+xLi+
D.若放电时转移 0.2 mol 电子,则消耗锂的质量为 1.4x g
难度: 中等查看答案及解析
-
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2=2Fe(OH)2。以下说法正确的是( )
A. 负极发生的反应为:Fe-2e-=Fe2+
B. 正极发生的反应为:2H2O+O2+2e-=4OH-
C. 原电池是将电能转变为化学能的装置
D. 钢柱在水下部分比在空气与水交界处更容易腐蚀
难度: 困难查看答案及解析
-
常温下,取0.2 mol·L-1 HX溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列关于混合溶液的说法(或关系式)正确的是
A.c(Na+)-c(X-)=9.9×10-7 mol·L-1
B.c(Na+)=c(X-)+c(HX)=0.2 mol·L-1
C.c(OH-)-c(HX)=c(H+)=1×10-6 mol·L-1
D.c(Na+)>c(X-)>c(HX)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
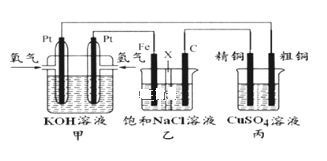
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
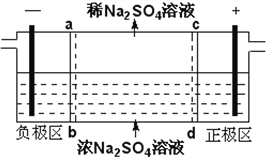
A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
难度: 中等查看答案及解析
-
铁镍可充电电池以KOH溶液为电解液,放电时的总反应为Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,下列有关该电池的说法正确的是
A.放电时,K+向Fe电极迁移
B.放电时,正极反应式为Fe-2e-+2OH-=Fe(OH)2
C.充电时,阴极附近溶液的pH增大
D.充电时,阴极反应式为2Ni(OH)2-2e-+2OH-=Ni2O3+3H2O
难度: 中等查看答案及解析