-
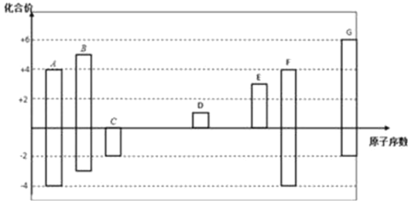
下列关于化学用语的表述正确的是( )
A.原子核内有8个中子的碳原子
C
B.HClO的结构式为H-Cl-O
C.Ca2+的结构示意图为
D.NH4Cl的电子式
难度: 中等查看答案及解析
-
下列物质间的反应,其能量变化符合如图的是( )
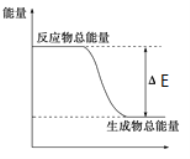
A.碳酸钙的分解 B.灼热的炭与二氧化碳反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合 D.钠和水反应
难度: 简单查看答案及解析
-
某元素的二价阳离子(R2+)核外有18个电子,质量数为42,该元素原子的原子核中的中子数为( )
A.18 B.20 C.16 D.22
难度: 简单查看答案及解析
-
1999年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298。以下叙述不正确的是( )
A.该元素属于第七周期
B.该元素位于ⅢA 族
C.该元素为金属元素,性质与C相似
D.该同位素原子含有114个电子,184个中子
难度: 简单查看答案及解析
-
X、Y是元素周期表中的两种元素。下列叙述中能说明X的非金属性比Y强的是( )
A.X氢化物水溶液的酸性比Y的氢化物水溶液的酸性强
B.达8电子结构时X原子得到电子数比Y多
C.X的氧化物的水化物的酸性比Y的氧化物的水化物的酸性强
D.X的单质能将Y从NaY 的溶液中置换出来
难度: 简单查看答案及解析
-
短周期元素甲和乙,甲原子的最外层电子数为a,次外层电子数为b;乙原子的M层电子数为(a–b),L层电子数为(a+b)。则甲、乙两元素形成的化合物具有的性质是( )
A.与水反应 B.与氢氧化钠溶液反应
C.与硫酸反应 D.与前三种物质均能反应
难度: 中等查看答案及解析
-
A、B、C、D均为短周期主族元素,原子序数依次增大,其原子的最外层电子数之和为18,A和C同主族,B原子的电子层数与最外层电子数相等,B、C、D的单质均可与NaOH溶液反应。下列说法正确的是
A.原子半径:C>A,简单离子半径:B>D
B.简单氢化物的热稳定性:A>C,氧化物对应水化物的酸性:D>B
C.B、C的氧化物均是高熔点物质,故B、C的氧化物中化学键类型相同
D.可用A的单质制备C的单质,可用电解法由B、D形成的化合物BD3制备B单质
难度: 中等查看答案及解析
-
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是 ( )
A.元素A、B组成的化合物常温下一定呈气态
B.一定条件下,元素B、C、D的最高价氧化物对应的水化物之间两两皆能发生反应
C.工业上常用电解法制备元素E的单质
D.化合物AE与AC含有相同类型的化学键
难度: 简单查看答案及解析
-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是 ( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的沸点:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
难度: 简单查看答案及解析
-
元素A的阳离子aAm+与元素B的阴离子bBn—具有相同的电子层结构。以下关于A、B元素性质的比较中,正确的是
①原子序数:A>B ②离子半径:aAm+<bBn—
③原子半径:A<B ④元素所在的周期序数:A>B
⑤A的最高正价与B的最低负价的绝对值相等 ⑥b = a+m-n
A.②③④ B.①②④ C.④⑤⑥ D.②⑤⑥
难度: 中等查看答案及解析
-
下列各组反应(表中物质均为反应物),在反应刚开始时,放出H2的速率最快的是
选项
金属
(粉末状)/mol
酸的浓度及体积
反应温度
A
Mg 0.1
8 mol·L-1硝酸10 mL
60 ℃
B
Mg 0.1
3 mol·L-1盐酸10 mL
60 ℃
C
Fe 0.1
3 mol·L-1盐酸10 mL
60 ℃
D
Mg 0.1
3 mol·L-1硫酸10 mL
60 ℃
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2mol•L-1 降到 0.8mol•L-1 需要 20s,那么反应物浓度再由 0.8mol•L-1 降到 0.2mol•L-1 所需要的时间为
A.10s B.大于 10s C.小于 10s D.无法判断
难度: 中等查看答案及解析
-
反应2A+B = 3C+4D(物质均为气体)中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=4 mol·L-1·min-1
难度: 简单查看答案及解析
-
下列关于实验现象的描述不正确的是 ( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片作负极,铜片作正极,在 CuSO4溶液中,铜片质量增加
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.Al 和 Cu 分别作为两电极,用导线连接插入浓硝酸中,铜溶解,溶液变成蓝色
难度: 简单查看答案及解析
-
如图所示,烧杯中盛的是水,铁圈和银圈直接相连,在接头处用一根绝缘细丝吊住,并使之平衡。小心地从烧杯中央滴入CuSO4溶液,反应一段时间后,观察到的现象是
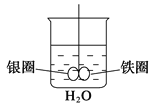
( )
A.两圈仍保持平衡
B.有气泡产生,两圈摇摆不定
C.铁圈向下倾斜
D.银圈向下倾斜
难度: 简单查看答案及解析
-
在一定条件下,将3molA和1molB投入容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)
xC(g)+2D(g)。2min末测得此时容器中C和D的浓度为0.2mol/L和0.4mol/L。下列叙述正确的是( )
A.x=2
B.2min时,容器内的压强为开始时的80%
C.2min时,B的反应速率为0.1mol·L-¹·min-¹
D.A的转化率为40%
难度: 简单查看答案及解析
-
工业上用CO和H2生产燃料甲醇(CH3OH)。一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态)。下列说法错误的是
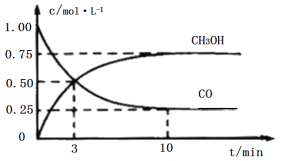
A.反应的化学方程式:CO+2H2⇌CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,ʋ(CO)=0.075mol/(L·min−1)
D.反应至3分钟,用甲醇来表示反应的平均速率为
mol/(L·min−1)
难度: 中等查看答案及解析
-
可逆反应:
(所有物质均为气体)在恒容容器中进行,达到平衡状态的标志是 ( )
① 混合气体的压强不再改变的状态
② 单位时间内生成n mol NO2的同时生成2n mol O2
③ 用NO2、NO、O2表示的反应速率之比为2:2:1的状态
④ 混合气体的颜色不再改变的状态
⑤ 混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤
C.①③④ D.①②③④⑤⑥
难度: 简单查看答案及解析