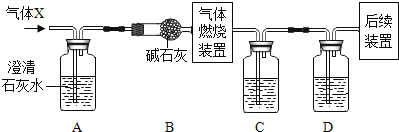
-
已知乙酸乙酯(C4H8O2)是一种无色液体,不溶于水,密度小于1 g·mL-1,沸点约为55 ℃。要从水与乙酸乙酯的混合物中将乙酸乙酯分离出来,下列方法中最简便的是
A.蒸馏 B.分液 C.过滤 D.蒸发
难度: 简单查看答案及解析
-
化学实验中的安全意识是一种重要的科学素养。下列实验操作中不正确的是
A.CO气体有毒,尾气处理时可以将其点燃,转化为无毒的CO2
B.在盛有O2的集气瓶中进行铁丝燃烧实验时,事先在集气瓶底部放一些水
C.稀释浓硫酸时,先在量筒中加入一定量的水,再慢慢地加入浓硫酸并搅拌
D.给试管内的液体加热时,试管口不能对着他人或自己
难度: 简单查看答案及解析
-
能正确表示阿伏加德罗常数的值的是( )
A.常温常压下,0.5molH2中含有的H原子数
B.22.4LHCl气体中含有的Cl原子
C.1L1mol/L硫酸溶液所含的H+数
D.0.1mol金属钠含有的电子数
难度: 简单查看答案及解析
-
下列说法正确的是
A. 同温同压下,相同体积的物质,其物质的量一定相等
B. 标准状况下气体摩尔体积约为22.4L
C. 0.5 L 1 mol/L FeCl3溶液与0.2 L 1 mol/L KCl溶液中的Cl-的数目之比为15∶2
D. 100 mL 1 mol/L NaCl溶液与50 mL 1 mol/L AlCl3溶液中Cl-物质的量浓度相等
难度: 中等查看答案及解析
-
在同温、同压下,有同质量的气体X和Y,已知此时Y的体积大于X的体积,则它们的摩尔质量之间的关系是( )
A.M(X)>M(Y) B.M(X)<M(Y) C.M(X)=M(Y) D.无法确定
难度: 中等查看答案及解析
-
下列所得溶液的物质的量浓度为0.1mol/L的是( )
A. 将0.1mol氨充分溶解在1L水中
B. 将10g质量分数为98%的硫酸与990g水混合
C. 将25.0g胆矾溶于水配成1L溶液
D. 将10mL1mol/L的盐酸与90mL水充分混合
难度: 简单查看答案及解析
-
分离FeCl3、KCl、BaSO4的固体混合物,应采用的一组试剂是( )
A.水、硝酸银溶液、稀硝酸 B.水、氢氧化钠溶液、盐酸
C.水、氢氧化钾溶液、盐酸 D.水、氢氧化钾溶液、硫酸
难度: 中等查看答案及解析
-
仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能实现相应实验目的的是( )
选项
A
B
C
D
实验目的
除去KCl中少量的MnO2
用10mol·L-1的盐酸配制100mL0.1 mol·L-1的盐酸
用氯化钠溶液制备氯化钠晶体
除去CO2气体中的HCl
实验仪器或装置
烧杯、玻璃棒、分液漏斗
100mL容量瓶、玻璃棒、烧杯

A.A B.B C.C D.D
难度: 简单查看答案及解析
-
如果2 g甲烷含有x个甲烷分子,那么22 g CO2中所含分子数是( )
A.4x B.3x C.x D.0.5x
难度: 中等查看答案及解析
-
某铁的氧化物中铁元素和氧元素的质量比为21∶8,该氧化物的化学式可能是
A.FeO B.Fe2O3 C.Fe3O4 D.Fe4O5
难度: 简单查看答案及解析
-
标准状况下,11.2LCO和CO2混合气体质量为20.4g,下列说法正确的是( )
A.混合气体中CO和CO2的体积比1∶4
B.混合气体中CO和CO2的体积比4∶1
C.混合气体中CO和CO2的质量比为1∶4
D.混合气体中CO和CO2的平均相对分子质量为40.8g/mol
难度: 中等查看答案及解析
-
为了除去硝酸钾晶体中所含的硫酸钙和硫酸镁,先将它配成溶液,然后加入KOH、K2CO3、Ba(NO3)2等试剂,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体,其加入试剂的顺序正确的是( )
A.Ba(NO3)2—KOH—K2CO3—HNO3
B.Ba(NO3)2—KOH—HNO3—K2CO3
C.KOH—K2CO3—Ba(NO3)2—HNO3
D.K2CO3—Ba(NO3)2—KOH—HNO3
难度: 中等查看答案及解析
-
根据下列各题所给出的数据,得出的结论错误的是( )
A.同温同压下,VLCO和H2的混合气体,完全燃烧消耗O2的体积为
L
B.已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液中氢氧化钠的质量分数
%
C.4.2g氮气和4.8g某单质RX所含原子个数相同,且分子个数之比为1:1,则R的相对原子质量为16
D.在10%的NaOH溶液中,平均每9个水分子溶有1个OHˉ
难度: 中等查看答案及解析
-
已知4 g RO32-中核外电子数比质子数多6.02×1022个,则元素R的相对原子质量为( )
A. 12 B. 27 C. 32 D. 80
难度: 简单查看答案及解析
-
以“物质的量”为中心的计算是化学计算的基础。下列与“物质的量”相关的计算正确的( )
A.现有CO、CO2、O3三种气体,它们分别都含有1molO,则三种气体的物质的量之比为 3∶2∶1
B.5.6g CO 和22.4L CO2中含有的碳原子数一定相等
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为 35.5m/n
难度: 中等查看答案及解析
-
下列各组数据中,前者刚好是后者两倍的是( )
A.2 mol水的摩尔质量和1 mol水的摩尔质量
B.1 mol/L氯化钙溶液中n(Cl-)和2 mol/L氯化钾溶液中n(Cl-)
C.64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
难度: 中等查看答案及解析
-
溶质质量分数为98%的浓硫酸(ρ=1.84g/mL),其物质的量浓度为18.4mol/L,取10mL该硫酸与amL水混合,配制成溶质质量分数为49%的硫酸(ρ=1.40g/mL),其物质的量浓度为bmol/L,则a、b分别为( )
A.a>10 b<9.2 B.a<10 b>9.2
C.a=10 b=9.2 D.a>10 b=9.2
难度: 中等查看答案及解析
-
在某温度下,NaOH的溶解度为20克,该温度下将80克NaOH放入220克水中,充分搅拌后,测的溶液的密度为1.2 g/mL ,则溶液中溶质的物质的量浓度为( )
A.0.02mol/L B.2.0mol/L C.5.0 mol/L D.7.5mol/L
难度: 中等查看答案及解析
-
使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是( )
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②用量筒量取液体时,仰视读数
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A.① ③ ⑤ ⑥ B.① ② ⑤ ⑥ C.② ③ ④ ⑥ D.③ ④ ⑤ ⑥
难度: 中等查看答案及解析
-
下列与实验操作或离子检验有关的说法正确的是( )
A.称量一定质量NaCl固体时,没有用烧杯,直接放在右盘的滤纸上
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42ˉ
C.蒸发时,待水分完全蒸干后才能停止加热
D.加入硝酸酸化的硝酸钡溶液既无沉淀又无气体产生,再加入硝酸银溶液,立刻产生白色沉淀,一定有Clˉ
难度: 中等查看答案及解析