-
下列有关说法中正确的是( )
A.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+ 2CO2(g)在低温下能自发进行,则该反应的△H<0
B.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H <0
C.若△H>0,△S<0,化学反应在任何温度下都能自发进行
D.加入合适的催化剂能降低反应活化能,从而改变反应的焓变
难度: 简单查看答案及解析
-
常温下,下列溶液中,有关微粒物质的量浓度关系正确的是
A.0.1mol·L−1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(H+)>c(Fe2+)
B.将100mL0.1mol·L−1 Na2CO3溶液逐滴滴加到100mL0.1mol·L−1盐酸中:c(Na+)>c(Cl−)>c(HCO3-)>c(CO32-)
C.pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后:c(CH3COO−)>c(Na+)>c(H+)>c(OH−)
D.0.1mol·L−1NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH−)+c(CO32-)
难度: 中等查看答案及解析
-
能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是
①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2 ④向水中通NH3 ⑤向水中加入明矾晶体 ⑥向水中加入NaHCO3固体 ⑦向水中加NaHSO4固体
A. ①③⑥⑦ B. ①③⑥ C. ⑤⑦ D. ⑤
难度: 中等查看答案及解析
-
下列对核外电子运动状态的描述正确的是( )
A.电子的运动与行星的运动相似,围绕原子核在固定的轨道上高速旋转
B.能层数为3时,有3s、3p、3d、3f四个轨道
C.氢原子中只有一个电子,故只有一个轨道,不能发生跃迁而产生光谱
D.在同一能级上运动的电子,其运动状态肯定不同
难度: 中等查看答案及解析
-
以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( )
A.He B.
C.
D.1s2
难度: 简单查看答案及解析
-
以下有关元素性质的说法不正确的是
A.具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22s22p63s23p4原子半径最大的是①
B.具有下列最外层电子排布式的原子中,①3s23p1②3s23p2③3s23p3④3s23p4第一电离能最大的是③
C.①Na、K、Rb ②N、O、S ③Si、P、As ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④
D.某元素基态原子的逐级电离能分别为578、1817、2745、11575、14830、18376、23293,当它与氯气反应时可能生成的阳离子是X2+
难度: 中等查看答案及解析
-
某温度下气体反应达到化学平衡,平衡常数
。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
A.恒容时,向容器中充入稀有气体,反应速率不变
B.增大c(A)、c(B),K增大
C.该反应的化学方程式为2E(g)+F(s)⇌A(g)+2B(g)
D.正反应为放热反应
难度: 简单查看答案及解析
-
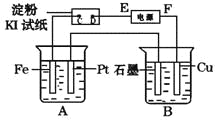
某同学组装了如图所示的电化学装置,电极Ⅰ为Zn,其他电极均为Cu,则下列说法正确的是
A.电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极Ⅱ
B.电极Ⅰ发生还原反应
C.电极Ⅳ逐渐溶解
D.电极Ⅲ的电极反应:Cu-2e-===Cu2+
难度: 中等查看答案及解析
-
在N2+3H2
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6 mol·L-1。在此段时间内用H2表示的平均反应速率为0.45 mol·L-1·s-1,则反应所经过的时间是( )
A.0.44 s B.1 s C.1.33 s D.2 s
难度: 困难查看答案及解析
-
反应mA(g)+nB(g)
pC(g)的速率和平衡的影响图像如下,下列判断正确的是
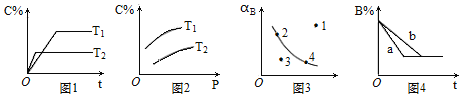
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n﹤p
C.图3中,表示反应速率υ正<υ逆的是点1
D.图4中,若m+n=p,则a曲线一定使用了催化剂
难度: 中等查看答案及解析
-
已知反应:2NO(g)+Br2(g)
2NOBr(g) ΔH=-a kJ·mol−1(a>0),其反应机理如下
①NO(g)+Br2(g)
NOBr2(g) 快
②NO(g)+NOBr2(g)
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 增大Br2(g)浓度能增大活化分子百分数,加快反应速率
D. 正反应的活化能比逆反应的活化能小a kJ·mol−1
难度: 简单查看答案及解析
-
下列说法不正确的是
A.马口铁镀锡的表面即使破损后也能起到很好的防锈作用
B.FeCl3饱和溶液滴入到沸水中,并继续煮沸,可得到Fe(OH)3沉淀
C.反应AgCl+NaBr===AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.除去某溶液中的SO42-,选择加入可溶性钡盐要比加入钙盐好
难度: 中等查看答案及解析
-
甲、乙、丙是三种不含相同离子的可溶性电解质。它们所含的离子如下表所示
阳离子
NH4+、Na+、Mg2+
阴离子
OH-、NO3-、SO42-
取等质量的三种化合物配制相同体积的溶液,其物质的量浓度:c(甲)>c(乙)>c(丙),下列说法错误的是
A.甲中一定含Na+
B.乙中一定含NH4+
C.丙中一定含Mg2+
D.丙中一定含SO42-
难度: 中等查看答案及解析
-
下列实验操作合理或能达到实验目的的是
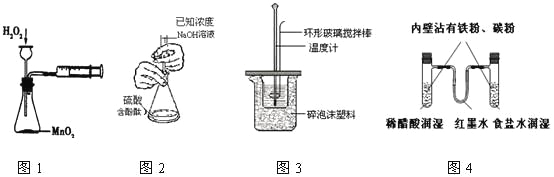
A.图1:实验目的是定量测定化学反应速率
B.图2:用标准NaOH溶液滴定待测H2SO4溶液的物质的量浓度
C.图3:将0.1mol/L 55mLNaOH溶液逐滴加入到0.1mol/L50mL盐酸溶液中测中和热
D.图4:模拟铁的腐蚀实验
难度: 简单查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B.已知C(s)+O2(g)=CO2(g) ΔH1;C(s)+
O2(g)=CO(g) ΔH2,则ΔH2>ΔH1
C.已知2H2(g)+O2(g)=2H2O(g) ΔH= -483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol
难度: 中等查看答案及解析
-
常温下,H2SO3的电离常数:Ka1=1.54×10−2,Ka2=1×10−7。向mmL0.1mol/LH2SO3溶液中滴加0.1mol·L−1KOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示,下列说法不正确的是

A.m=10
B.c点对应的溶液中存在c(K+)>c(HSO3-)+2c(SO32−)
C.b、d两点溶液的pH=7
D.SO32-+H2O⇌HSO3-+OH−的K=1×10−7
难度: 中等查看答案及解析