-
化学与生产、生活等密切相关。下列说法错误的是( )
A.Al(OH)3可用于阻燃剂的材料
B.焊接金属前常用氯化铵溶液处理焊接处
C.二氧化氯用作自来水的净化与消毒
D.高锰酸钾的稀溶液可用于治疗脚癣
难度: 简单查看答案及解析
-
下面是某有机合成的部分片段:

下列有关说法正确的是( )
A.有机物B中所有碳原子均可能共平面
B.反应②属于加成反应
C.有机物C可能存在带苯环的同分异构体
D.有机物A、B、C都能发生氧化反应
难度: 中等查看答案及解析
-
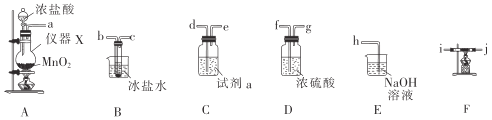
NaH是有机合成中用途很广泛的物质。已知NaH遇水蒸气剧烈反应,某小组设计如图实验装置制备NaH,下列说法正确的是( )

A.安全漏斗的作用是“液封”
B.装置A中的试剂是稀硝酸和粗锌
C.装置B中的试剂是NaOH溶液
D.实验开始后先点燃C处酒精灯,再启动A中反应
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期主族元素。甲、乙、丙是由这些元素组成的化合物,M、N、P是这些元素对应的单质,甲常温下为液态,丙中滴入盐酸开始有沉淀,继续沉淀消失,其溶液呈碱性。上述物质间的转化关系如图所示。下列说法错误的是( )
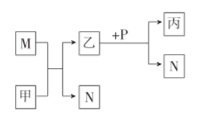
A.原子半径:Z>W>Y
B.X与Z形成的化合物能与水反应产生N
C.常温下,P不能与浓硝酸发生反应
D.Y分别与X、Z形成的化合物均不止一种
难度: 中等查看答案及解析
-
工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。
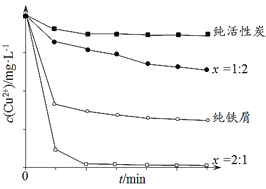
下列推论不合理的是
A.活性炭对Cu2+具有一定的吸附作用
B.铁屑和活性炭会在溶液中形成微电池,铁为负极
C.增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D.利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
难度: 中等查看答案及解析
-
Li-SO2充电电池具有高输出功率的优点。多孔碳电极可吸附SO2,电解液为溶解有LiBr的碳酸丙烯酯-乙腈溶液。下列说法错误的是( )
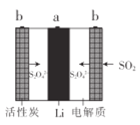
A.活性炭具有加快放电速率的作用
B.放电时,电子流向:a→溶液→b→a
C.充电时,阳极上发生的电极反应为:S2O42--2e-=2SO2
D.该电池的电解质溶液不能换成LiBr的水溶液
难度: 中等查看答案及解析
-
某研究性学习小组为研究水垢的生成,查得CaCO3和Mg(OH)2溶解度曲线如图所示。已知:40°C时,Ksp(MgCO3)=7×10-6,下列有关分析错误的是( )
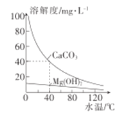
A.CaCO3、Mg(OH)2溶解均放热
B.MgCl2溶液中加入少量CaCO3粉末加热搅拌,有Mg(OH)2生成
C.含有Ca(HCO3)2和Mg(HCO3)2的自来水长时间加热,水垢的主要成分为CaCO3和MgCO3
D.40℃时,Ksp(CaCO3)=1.6×10-7
难度: 中等查看答案及解析
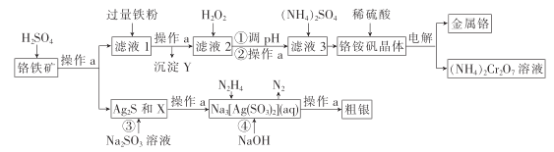
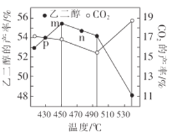
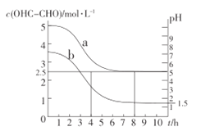

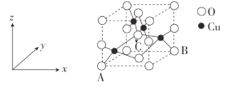

 的流程示意图___。
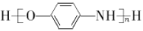
的流程示意图___。