-
化学与生活、生产、社会发展息息相关。下列说法正确的是
A.气象报告中的“PM2.5”是指一种胶体粒子
B.聚乳酸酯的降解和油脂的皂化都是高分子生成小分子的过程
C.“玉兔二号”的太阳能电池帆板的材料是二氧化硅
D.疫苗一般应冷藏存放,其目的是防止蛋白质变性
难度: 简单查看答案及解析
-
下列分子或离子中,VSEPR(价层电子对互斥理论)模型名称与分子或离子的空间构型名称不一致的是
A.CO2 B.CO32- C.H2O D.CC14
难度: 简单查看答案及解析
-
结构简式如图所示的有机物常用于合成药物,下列对该有机物说法不正确的是
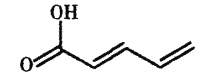
A.存在顺反异构体
B.与丙烯酸互为同系物
C.有两种官能团
D.与H2按等物质的量关系反应时,可能有3种加成产物
难度: 中等查看答案及解析
-
玻璃棒是化学实验中常用的仪器之一,其主要用于搅拌、过滤或转移液体时的引流。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是
①用pH试纸测定Na2CO3溶液的pH
②从氯酸钾和二氧化锰制取氧气的剩余固体中提取KC1
③用饱和FeC13溶液和沸水制取Fe(OH)3胶体
④配制一定物质的量浓度的氯化钠溶液
⑤取某溶液做焰色试验,检验该溶液中是否含有钠元素
⑥用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
⑦促使过饱和的硝酸钾溶液析出晶体
A.①②④⑤ B.③④⑤⑦ C.③⑤ D.⑤⑥⑦
难度: 中等查看答案及解析
-
Z是合成某药物的中间体,其合成原理如下:
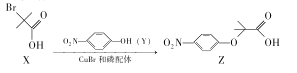
下列说法正确的是.
A.用NaHCO3溶液可以鉴别X和Z B.X、Y、Z都能发生取代反应
C.X分子所有碳原子可能共平面 D.与X具有相同官能团的同分异构体还有5种
难度: 中等查看答案及解析
-
W、X、Y、Z为原子序数依次递增的短周期主族元素,其中X的某同位素可用于测量文物年代,M为由X元素构成的一种单质。甲和丁两种物质都由W和Y元素组成,乙由Y和Z元素组成,常温下为气体,具有漂白性,戊为二元强酸。它们之间的转化关系如下,下列叙述正确的是( )
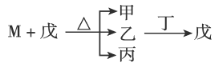
A.气态氢化物的稳定性:X>Y>Z B.原子半径顺序:Z>Y>X>W
C.丁的水溶液适用于医用伤口消毒及环境消毒 D.常温常压下,M能和丙发生化合反应
难度: 中等查看答案及解析
-
下列实验操作、现象与预期实验目的或所得实验结论一致的是

A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知磷酸分子(
)中的三个氢原子都可与重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。则下列说法正确的是
A.H3PO2在水溶液中发生电离:H3PO2
H++H2PO2-、H2PO2-
H++HPO22-
B.H3PO4属于三元酸、H3PO2属于二元酸
C.NaH2PO2属于酸式盐,其水溶液呈酸性
D.H3PO2具有较强的还原性,其结构式为
难度: 中等查看答案及解析
-
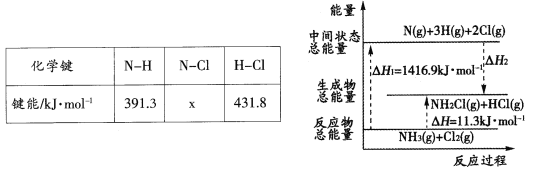
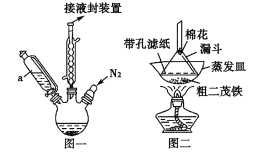
二氧化氯(C1O2)是易溶于水且不与水反应的黄绿色气体,沸点为11℃。某小组在实验室中制备C1O2的装置如下:[已知:SO2+2NaC1O3+H2SO4=2C1O2+2NaHSO4]

下列说法正确的是
A.连接装置时,导管口a应接h或g,导管口c应接e
B.装置C中装的是饱和食盐水,导管口a通过的气体为SO2
C.装置D放冰水的目的是液化SO2,防止污染环境
D.可选用装置A,用1 mol·L-1盐酸与MnO2反应制取Cl2
难度: 中等查看答案及解析
-
化学反应中绚丽的颜色变化往往展现了化学的神奇,体现了化学之美。下列变化中的a、b、c、d可以是混合物,关于物质类别或者反应类型的叙述一定正确的是
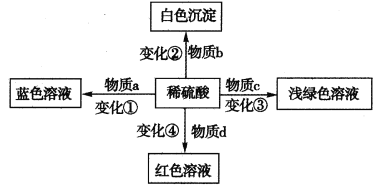
A.变化①一定不属于氧化还原反应
B.变化②得到的白色沉淀一定是硫酸盐
C.物质c中一定不能含有铁红或磁性氧化铁
D.物质d可能是某有机物的水溶液
难度: 中等查看答案及解析
-
工业上可用铁盐溶液溶解黄铁矿(主要成分为FeS2),发生如下过程。下列说法错误的是
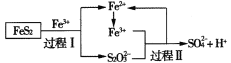
A.过程I每溶解120 g FeS2,理论上消耗6 mol Fe3+
B.过程Ⅱ每生成1 mol SO42-转移8 mol e-
C.总反应为FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+
D.反应过程中鼓入大量的空气有利于反应的进行
难度: 中等查看答案及解析
-
T℃时,在20.00 mL 0.10 mol/LCH3COOH溶液中滴入0.10 mol/LNaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。下列说法正确的是
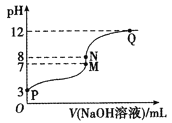
A.T℃时,CH3COOH的电离平衡常数Ka=1.0×10-3
B.M点对应的NaOH溶液的体积为20.00 mL
C.N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.N点与Q点所示溶液中水的电离程度:N>Q
难度: 中等查看答案及解析
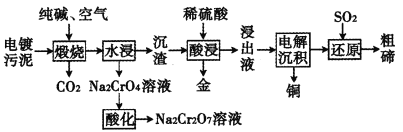
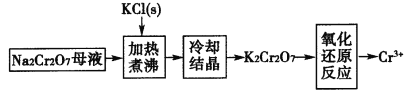
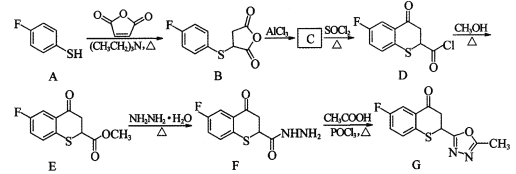
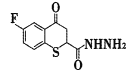
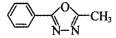 的合成路线流程图(其他试剂任选)。_____________________________。
的合成路线流程图(其他试剂任选)。_____________________________。