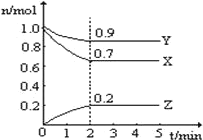
-
取少量无机盐溶液试样对其中的离子进行检验.下列判断正确的是( )
A. 加入盐酸,产生白色沉淀,则试样中一定有Ag+
B. 加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32﹣或HCO3﹣
C. 加入NaOH溶液微热,产生使湿润红色石蕊试纸变蓝气体,则试样中一定有NH4+
D. 加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,则试样中一定有SO42﹣
难度: 中等查看答案及解析
-
实验室将NaClO3和Na2SO3按物质的量为2:1放入烧杯中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X的化学式为
A. Cl2 B. Cl2O C. ClO2 D. Cl2O3
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X的原子核内只有一个质子,Y原子最外层比W原子最外层多1个电子,Z的单质是空气中含量最高的气体,W单质在常温下能被浓硫酸钝化。下列说法正确的是
A.原子半径:Y<Z<W B.简单离子半径:Z> W
C.X、Y形成的化合物只含有极性键 D.Y的最高价氧化物对应水化物酸性比Z的强
难度: 中等查看答案及解析
-
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池.①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少.据此判断这四种金属活泼性由大到小的顺序是( )
A.①③②④ B.①③④② C.③④②① D.③①②④
难度: 中等查看答案及解析
-
下列说法正确的是( )
①正常雨水的pH为7.0,酸雨的pH小于7.0;
②严格执行机动车尾气排放标准有利于防止大气污染;
③Fe2O3常用作红色油漆和涂料;
④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害;
⑤SiO2可用于制太阳能电池。
A.①②③ B.①④⑤
C.②③④ D.③④⑤
难度: 简单查看答案及解析
-
为了除去粗盐中的少量泥沙和Ca2+、Mg2+、SO42—等杂质离子,先将粗盐溶于水,过滤,然后对滤液进行4项操作:①过滤 ②加适量盐酸 ③加过量的NaOH和Na2CO3混合溶液 ④加入过量BaCl2溶液。上述4项操作的正确顺序为
A.③④①② B.④③②①
C.④③①② D.③④②①
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.62g Na2O溶于水后所得溶液中含有O2-离子数为NA
B.7.8gNa2S和7.8g Na2O2中含有的阴离子数目均为0.1NA
C.标准状况下,22.4 LSO3中含有3NA个氧原子
D.合成氨反应中1mol氮气与3mol氢气反应,转移电子数为6NA
难度: 简单查看答案及解析
-
下列体系中,离子能大量共存的是
A.无色透明的酸性溶液:MnO4-、K+、C1-、SO42-
B.使酚酞变红的溶液:K+、Na+、NO3-、Cl-
C.滴加KSCN显红色的溶液:NH4+、K+、Cl-、OH-
D.0.1 mol·L-1 NaHCO3溶液: Na+、Ba2+、NO3-、OH-
难度: 简单查看答案及解析
-
下列说法正确的是
A.实验室保存FeSO4溶液常在溶液中加入少量铁粉
B.可用澄清石灰水鉴别Na2CO3和NaHCO3溶液
C.可以用饱和Na2CO3除去CO2中少量SO2
D.Na2SiO3溶液常常保存在带玻璃塞的细口瓶中
难度: 简单查看答案及解析
-
下列叙述中错误的是 ( )
A.原子半径:Cl>S>O B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr D.酸性:HClO4>H2SO4>H3PO4
难度: 中等查看答案及解析
-
纽扣电池可作计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn和Ag2O,用KOH溶液作电解质溶液,电池的总反应为Zn+Ag2O===2Ag+ZnO。关于该电池下列叙述不正确的是( )
A. 正极的电极反应为Ag2O+2e-+H2O===2Ag+2OH-
B. Zn极发生氧化反应,Ag2O极发生还原反应
C. 使用时电子由Zn极经外电路流向Ag2O极,Zn是负极
D. 使用时溶液中电流的方向是由Ag2O极流向Zn极
难度: 中等查看答案及解析
-
化学与社会、生产和生活密切相关。下列说法错误的是
A.科学家在室温下将气态二氧化碳转化为固体碳材料,该变化是化学变化
B.中国天眼用到碳化硅,芯片用到高纯硅,石英玻璃用到硅酸盐
C.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机金属材料
D.看电影时,我们可以看到放映机投射的光柱,这是气溶胶发生的丁达尔现象
难度: 简单查看答案及解析
-
可逆反应2A+2B⇌C+3D 各物质均为气体在不同情况下测得有下列 4 种反应速率, 其中反应最快的是
A.v(A)=0.45mol·(L·s)
B.v(B)=0.6mol·(L·s)
C.v(C)=0.5mol·(L·s)
D.v(D)=0.4mol·(L·s)
难度: 简单查看答案及解析
-
如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )

A.铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B.如果将锌片换成铁片,电路中的电流方向将改变
C.其能量转化的形式主要是“化学能→电能→光能”
D.如果将稀硫酸换成柠檬汁,LED灯将不会发光
难度: 简单查看答案及解析
-
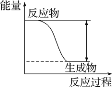
对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是( )
A. 反应过程中的能量关系可用图表示
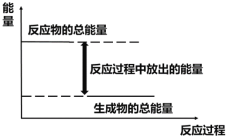
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则锌作正极
D. 若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气体一定为11.2 L
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量②将容器的体积减小一半③保持体积不变,充入氮气使体系的压强增大④保持压强不变,充入氮气使体系的体积增大
A.①② B.②③ C.①③ D.③④
难度: 简单查看答案及解析
-
在研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及能量的变化,据此判断以下叙述中错误的是( )
A. 金属钠与氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量降低
B. 物质的燃烧过程可看成“贮存”在物质内部的部分化学能转化为热能释放出来的过程
C. 氮分子内部存在着很强的共价键,故通常状况下氮气的化学性质很活泼
D. 需要加热才能发生的反应不一定是吸热反应
难度: 简单查看答案及解析
-
等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如下,其中正确的是( )。
A.
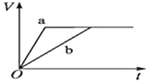 B.
B.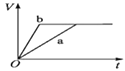
C.
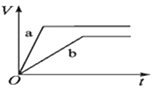 D.
D.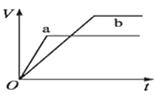
难度: 中等查看答案及解析
-
根据下面的信息,下列叙述正确的是( )
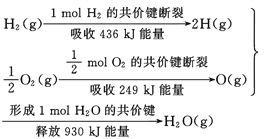
A.2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)吸收能量为490 kJ
B.化学反应中能量变化的大小与反应物的质量多少无关
C.1 mol H2(g) 跟0.5mol O2(g) 反应生成 1 mol H2O(l)释放能量为245 kJ
D.2molH2O (g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低
难度: 中等查看答案及解析
-
有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol/L,含硝酸的浓度为1mol/L,现向其中加入0.96g铜粉,充分反应后(假设只生成NO气体),最多可收集到标况下的气体的体积为
A.89.6mL B.112mL C.168mL D.224mL
难度: 困难查看答案及解析
-
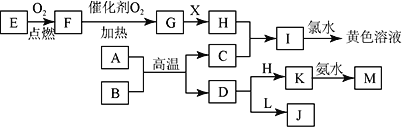
已知某物质X 能发生如下转化:

下列有关上述转化关系中物质及其反应的叙述错误的是
A. 若X为N2,则A为硝酸 B. 若X为S,则A为硫酸
C. 反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应 D. 若X 为非金属单质或非金属氢化物,则A 不一定能与金属铜反应生成Y
难度: 中等查看答案及解析