-
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是
A. 甲醇 B. 天然气 C. 氢气 D. 液化石油气
难度: 简单查看答案及解析
-
下列选项中描述的过程能实现热能转化为化学能的是( )
A.燃料电池 B.火力发电 C.铝热焊接 D.煅烧石灰石
难度: 简单查看答案及解析
-
下列物质中,其水溶液能导电,但自身属于非电解质的是( )
A.CH3COOH B.Na2O C.H2SO4 D.SO2
难度: 简单查看答案及解析
-
下列化学方程式书写错误的是( )
A.NaHCO3水解的离子方程式:HCO3-+ H2O
CO32-+H3O+
B.NH4Cl水解的化学方程式:NH4Cl+H2O
NH3·H2O+HCl
C.Al(OH)3的两性电离方程式:H++AlO2-+H2O
Al(OH)3
Al3++3OH−
D.NaHSO3的电离方程式:NaHSO3=Na++HSO3-
难度: 简单查看答案及解析
-
化学与社会、生活密切相关。下列说法正确的是( )
A.明矾净水与自来水的杀菌清毒原理相同
B.医学上常采用碳酸钡作为钡餐
C.钢铁析氢腐蚀和吸氧腐蚀的速率一样快
D.泡沫灭火剂利用了硫酸铝溶液与碳酸氢钠溶液混合后能发生双水解反应
难度: 简单查看答案及解析
-
在密闭容器中发生反应:C(s)+CO2(g)=2CO(g),下列说法不正确的是
A. 将碳块磨成粉末可以加快反应速率
B. 升高温度可以加快反应速率
C. 容器体积不变时,向其中充入N2,反应速率不变
D. 增加碳的质量可以加快反应速率
难度: 简单查看答案及解析
-
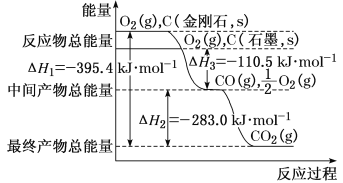
下列说法正确的是
A.任何酸与碱发生中和反应生成1mo1H2O的过程中,能量变化均相同
B.已知:① C(s石墨)+O2(g)=CO2(g) △H1=-393.5 kJ/mol② C(s金刚石)+O2(g)=CO2(g) △H2=-395.0 kJ/mol,则金刚石比石墨稳定
C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同
D.表示硫的燃烧热的热化学方程式:S(s) +3/2O2(g)=SO3(g);△H=-315kJ/mol
难度: 中等查看答案及解析
-
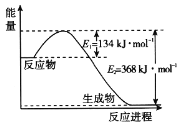
合成气(CO和H2)是目前化工常用的原料,下面是用甲烷制备合成气的两种方法:①CH4(g)+H2O(g)
CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;②2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。其中一个反应的反应过程与能量变化关系如图所示。则下列说法正确的是
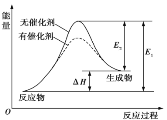
A. E1表示2CH4(g)+O2(g)=2CO(g)+4H2(g)的活化能
B. E2表示CH4(g)+H2O(g)
CO(g)+3H2(g)的活化能
C. 该图示为反应②的反应过程与能量变化示意图
D. 一般情况下,加入催化剂,既能降低E1,也能降低E2,但不能改变E1与E2的差值
难度: 中等查看答案及解析
-
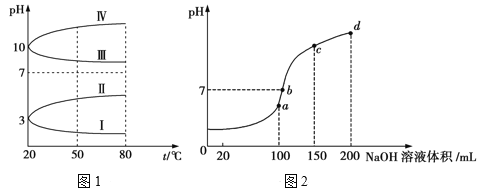
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是
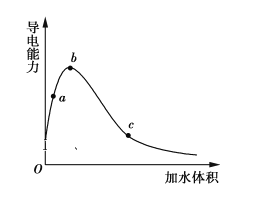
A.a、b、c三点溶液的pH:c<a<b
B.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
C.a、b、c三点CH3COOH的电离程度:c<a<b
D.a、b、c三点溶液用1 mol·L−1 NaOH溶液中和,消耗NaOH溶液体积:c<a<b
难度: 中等查看答案及解析
-
某学生以酚酞为指示剂用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,三次实验分别记录有关数据如下表:
滴定次数
待测氢氧化钠溶液的体积/mL
0.100 0 mol·L-1盐酸的体积/mL
滴定前刻度
滴定后刻度
第一次
25.00
0.00
27.45
第二次
25.00
0.00
30.30
第三次
25.00
0.00
27.55
下列说法正确的是:
A.当溶液从无色刚好变成红色时,则滴定终点达到
B.该氢氧化钠溶液中c(NaOH)=0.110 0 mol·L-1
C..滴定达终点时,滴定管尖嘴有悬液,则测定结果偏低
D.实验中锥形瓶应用待测氢氧化钠溶液润洗
难度: 中等查看答案及解析
-
常温下,下列有关溶液的说法正确的是
A.NaHCO3溶液加水稀释,c(Na+)与c(HCO3−)的比值将增大
B.pH=1的一元酸和pH=13的一元碱等体积混合后的溶液中:c(OH−)= c(H+)
C.0.1 mol·L−1硫酸铵溶液中:c(SO42−)> c(NH4+)> c(H+)> c(OH−)
D.0.1 mol·L−1的硫化钠溶液中:c(OH−)= c(H+)+ c(HS−)+ c(H2S)
难度: 中等查看答案及解析
-
气体的自动化检测中常常应用根据原电池原理设计的传感器。下图为电池的工作示意图,气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。

待测气体
部分电极反应产物
NO2
NO
Cl2
HCl
CO
CO2
H2S
H2SO4
则下列说法中正确的是
A. 上述气体检测时,敏感电极均作电池负极
B. 检测Cl2气体时,敏感电极的电极反应式为Cl2+2e-===2Cl-
C. 检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-===4OH-
D. 检测Cl2和CO体积分数相同的两份空气样本时,传感器上电流大小、方向相同
难度: 中等查看答案及解析
-
工业上冶炼钛的有关反应如下所示:
①C(s) + O2(g)
CO2(g) ΔH1
②2CO(g) + O2(g)
2CO2(g) ΔH2
③TiO2(s) + 2Cl2(g)
TiCl4(g) + O2(g) ΔH3
④TiCl4(s) + 2Mg(s)
2MgCl2(s) + Ti(s) ΔH4
⑤TiO2(s) + 2Cl2(g) + 2C(s)
TiCl4(g) + 2CO(g) ΔH5
下列有关推断正确的是( )
A.2ΔH1=ΔH2 B.ΔH1<0,ΔH2>0 C.ΔH5=ΔH3+2ΔH1-ΔH2 D.2ΔH1-ΔH2>0
难度: 困难查看答案及解析
-
已知:CO(g) + H2O(g)
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃
400
500
830
1000
平衡常数K
10
9
1
0.6
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大
难度: 中等查看答案及解析
-
如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1 mol A、2 mol B,此时甲、乙的容积均为2 L(连通管体积忽略不计)。在T℃时,两容器中均发生下述反应:A(g)+2B(g)
2C(g)+3D(g) △H < 0。达平衡时,乙的体积为2.6 L,下列说法正确的是
A.甲中反应的平衡常数小于乙
B.若打开活塞K,达平衡时乙容器的体积为3.2 L
C.当乙中A与B的体积分数之比为1:2时,反应达到平衡状态
D.平衡时甲容器中A的物质的量小于0.55 mol
难度: 困难查看答案及解析
-
一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp = cm(An+)·cn(Bm−),称为难溶电解质的溶度积。已知下表数据:
物质
Fe(OH)2
Cu(OH)2
Fe(OH)3
Ksp(25°C)
8.0×10−16
2.2×10−20
4.0×10−38
完全沉淀时的pH范围
≥9.6
≥6.4
3~4
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是( )
A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.该溶液中c(SO42−)∶[c(Cu2+)+c(Fe2+)+ c(Fe3+)]>5∶4
C.向该溶液中加入适量氯水,并调节pH到3〜4后过滤,可获得纯净的CuSO4溶液
D.在pH=5的溶液中Fe3+不能大量存在
难度: 困难查看答案及解析
-
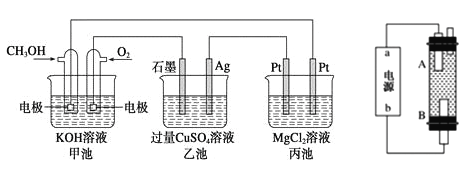
最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是
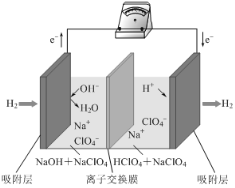
A. 右边吸附层中发生了还原反应
B. 负极的电极反应是H2-2e-+2OH-=2H2O
C. 电池的总反应是2H2+O2=2H2O
D. 电解质溶液中Na+向右移动,
向左移动
难度: 中等查看答案及解析
-
已知pAg+=−lgc(Ag+),pX−=−lgc(X−)。某温度下,AgBr、AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
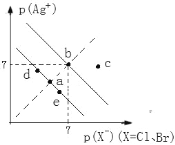
A. a和c两点的Kw相同
B. Ksp(AgCl)=1.0×10−14 mol2·L−2
C. 向饱和AgCl溶液中加入NaCl固体,可使a点变到d点
D. AgCl(s)+Br−(aq)
AgBr (s)+Cl−(aq)平衡常数K=Ksp(AgCl)/Ksp(AgBr)
难度: 中等查看答案及解析