-
FeSO4溶液不可能具有的性质是( )
A.还原性 B.氧化性 C.酸性 D.碱性
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol/LNa2CO3溶液:K+、SO42-、OH-
B.0.1mol/LNaOH溶液:NH4+、SO42-、Cl-
C.0.1mol/LFeCl3溶液:K+、SCN-、NO3-
D.0.1mol/LNaClO溶液:Na+、SO42-、S2-
难度: 中等查看答案及解析
-
下列说法不正确的是
A.pH<7的溶液不一定呈酸性
B.在相同温度下,物质的量浓度相等的氨水、NaOH溶液,c(OH-)相等
C.在相同温度下,pH相等的盐酸、CH3COOH溶液,c(Cl-)=c(CH3COO-)
D.氨水和盐酸反应后的溶液,若c(Cl―)=c(NH4+),则溶液呈中性
难度: 中等查看答案及解析
-
锌碘液流电池的工作原理如图所示,下列关于该电池工作时的说法不正确的是( )
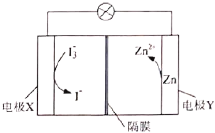
A.电极Y为电池的负极 B.溶液中的离子数目减少
C.电子由电极Y经外电路流向电极X D.电极X上的反应为
难度: 简单查看答案及解析
-
已知反应式:mX(g)+nY(?)⇌Q(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其它条件不变,将容器缩小到原来的
,c(X)=0.5mol/L,下列说法正确的是( )
A.反应向逆反应方向移动
B.Y可能是固体或液体
C.化学计量数n>m
D.Z的体积分数减小
难度: 中等查看答案及解析
-
以下反应可表示获得乙醇并用作汽车燃料的过程,下列有关说法正确的是( )
①6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH1
②C6H12O6(s)=2C2H5OH(l)+2CO2(g) ΔH2
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3
A.2ΔH3=ΔH1-ΔH2
B.ΔH3、ΔH1、ΔH2均为ΔH<0
C.在不同油耗汽车中发生反应③,ΔH3会不同
D.植物的光合作用通过反应①将热能转化为化学能
难度: 中等查看答案及解析
-
某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A. 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=Cl-+ ClO-+ H2O
B. 该消毒液的pH约为12:ClO-+ H2O
HClO+ OH-
C. 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D. 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO—
难度: 中等查看答案及解析
-
短周期主族元素
原子序数依次增大,
同主族且与
处于不同周期,
同主族且
的原子序数是
的两倍,以下说法正确的是
A.原子半径:
B.由
组成的化合物中可能含共价键
C.
元素最高价氧化物对应的水化物的酸性比
强
D.
的简单气态氢化物的热稳定性比
的弱
难度: 简单查看答案及解析
-
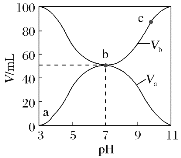
某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将
和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
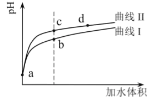
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
D.c点到d点,溶液中
保持不变(HA、A-代表相应的酸和酸根离子)
难度: 中等查看答案及解析
-
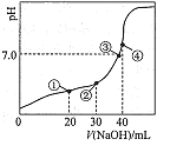
25℃时,在“H2A―HA-―A2-”的水溶液体系中,H2A、HA-和A2-三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是
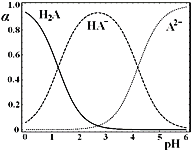
A.在含H2A、HA-和A2-的溶液中,加入少量NaOH固体,α(HA-)一定增大
B.将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)
C.NaHA溶液中,HA-的水解能力小于HA-的电离能力
D.在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)和α(HA-)一定相等
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.常温下,反应2Mg(s)+O2(g)=2MgO(s)能自发进行则△H>0
B.反应N2(g)+3H2(g)⇌2NH3(g)△H<0达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
C.镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的
D.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
难度: 中等查看答案及解析
-
绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
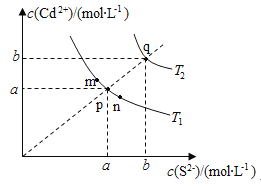
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
难度: 中等查看答案及解析
-
一定温度下(T2> Tl),在3个体积均为2.0 L的恒容密闭容器中反应 2NO(g)+ Cl2(g) = 2ClNO(g)(正反应放热)达到平衡,下列说法正确的是
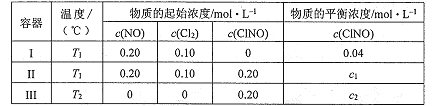
A.达到平衡时,容器I与容器II中的总压强之比为1:2
B.达到平衡时,容器III中ClNO的转化率小于80%
C.达到平衡时,容器II中c(ClNO(/ c(NO)比容器I中的大
D.若温度为Tl,起始时向同体积恒容密闭容器中充入0.20 mol NO(g)、0.2 mol Cl2(g)和0.20 mol ClNO(g),则该反应向正反应方向进行
难度: 困难查看答案及解析