-
已知C3N4晶体很可能具有比金刚石还大的硬度,且原子间均以单键结合.下列关于C3N4晶体的说法正确的是( )
A.C3N4晶体是分子晶体
B.C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要长
C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4晶体中微粒间通过离子键结合难度: 中等查看答案及解析
-
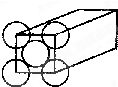
空间构型为正四面体,且键角为60∘的物质为( )
A.金刚石
B.SiO2
C.白磷
D.石墨难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.冰熔化时,分子中H-O键发生断裂
B.原子晶体中,共价键的键长越短,通常熔点就越高
C.分子晶体中,共价键键能越大,该分子的熔沸点就越高
D.分子晶体中,分子间作用力越大,则分子越稳定难度: 中等查看答案及解析
-
具有以下结构的原子,一定属于主族元素的是( )
A.最外层有8个电子的原子
B.最外层电子排布为ns2的原子
C.次外层无未成对电子的原子
D.最外层有3个未成对电子的原子难度: 中等查看答案及解析
-
有关晶格能的叙述正确的是( )
A.晶格能是气态离子形成1摩离子晶体释放的能量
B.晶格能通常取正值,但是有时也取负值
C.晶格能越大,形成的离子晶体越不稳定
D.晶格能越大,物质的硬度反而越小难度: 中等查看答案及解析
-
关于氢键,下列说法正确的是( )
A.每一个水分子内含有两个氢键
B.冰和水中都存在氢键
C.DNA双螺旋的两个螺旋链不是通过氢键相互结合的
D.H2O是一种非常稳定的化合物,这是由于氢键所致难度: 中等查看答案及解析
-
长式周期表共有18个纵行,从左到右排为1-18列,即碱金属为第一列,稀有气体元素为第18列.按这种规定,下列说法正确的是( )
A.第9列中元素中没有非金属元素
B.只有第二列的元素原子最外层电子排布为ns2
C.第四周期第9列元素是铁元素
D.第10、11列为ds区难度: 中等查看答案及解析
-
石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是( )
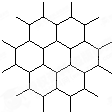
A.10个
B.18个
C.24个
D.14个难度: 中等查看答案及解析
-
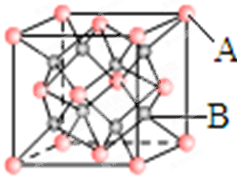
下列有关金属晶体的判断正确的是( )
A.简单立方堆积、配位数6、空间利用率68%
B.体心立方堆积、配位数6、空间利用率68%
C.六方最密堆积、配位数8、空间利用率74%
D.面心立方最密堆积、配位数12、空间利用率74%难度: 中等查看答案及解析
-
在乙烯分子中有5个σ键和1个π键,下列说法正确的是( )
A.乙烯与氢气发生加成反应,断裂的是σ键
B.sp2杂化轨道形成π键,未杂化的2p轨道形成σ键
C.C-H之间是sp2杂化轨道形成σ键,C-C之间有未杂化的2p轨道形成的π键
D.乙烯分子中所有原子不共平面难度: 中等查看答案及解析
-
下列固体分类中正确的一组是( )
离子晶体 原子晶体 分子晶体 A NaOH Ar SO2 B H2SO4 石墨 S C Na2CO3 水晶 P4O10 D Ba(OH)2 金刚石 玻璃
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
三氟化氮(NF3)是一种无色无味的气体,它是氨(NH3)和氟(F2)在一定条件下直接反应得到:4NH3+3F2=NF3+3NH4F.下列有关NF3的叙述正确的是( )
A.NF3是离子化合物
B.NF3的还原性比NH3强
C.NF3的氧化性比F2强
D.NF3中的N呈+3价难度: 中等查看答案及解析
-
下列关于粒子结构的描述不正确的是( )
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含一个极性键的18电子粒子
C.CH2C12和CCl4均是四面体构型的非极性分子
D.1 mol D216O中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数的值)难度: 中等查看答案及解析
-
据报道,科学家已成功合成了少量N4,有关N4的说法正确的是( )
A.N4是N2的同素异形体
B.N4是N2的同分异构体
C.相同质量的N4和N2所含原子个数比为1:2
D.N4的摩尔质量是56g难度: 中等查看答案及解析
-
A、B、C均为短周期的元素,A、B同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法正确的是( )
A.C元素的最高正价为+7价
B.原子半径:A>B>C
C.离子半径:A2->C->B2+
D.还原性:A2-<C-难度: 中等查看答案及解析
-
下列中心原子的杂化轨道类型和分子几何构型不正确的是( )
A.PCl3中P原子sp3杂化,为三角锥形
B.BCl3中B原子sp2杂化,为平面三角形
C.CS2中C原子sp杂化,为直线形
D.H2S分子中,S为sp杂化,为直线形难度: 中等查看答案及解析
-
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
A.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
D.氨气分子是极性分子而甲烷是非极性分子难度: 中等查看答案及解析
-
CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )
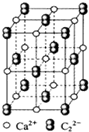
A.1个Ca2+周围距离最近且等距离的C22-数目为6
B.6.4克CaC2晶体中含阴离子0.1mol
C.该晶体中的阴离子与F2是等电子体
D.与每个Ca2+距离相等且最近的Ca2+共有12个难度: 中等查看答案及解析