-
下列能量转化过程与氧化还原反应无关的是
A. 硅太阳能电池工作时,光能转化成电能
B. 锂离子电池放电时,化学能转化成电能
C. 电解质溶液导电时,电能转化成化学能
D. 葡萄糖为人类生命活动提供能量时,化学能转化成热能
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3∶4。W-的最外层为8电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是
A.X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B.原子半径大小:X<Y,Z>W
C.化合物Z2Y和ZWY3都只存在离子键
D.Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.将铜插入稀硝酸中:Cu+4H++2NO3–=Cu2++2NO2↑+H2O
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
难度: 简单查看答案及解析
-
下列有关氯元素及其化合物的表示正确的是( )
A.质子数为17、中子数为20的氯原子:
B.氯离子(Cl-)的结构示意图:
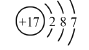
C.氯分子的电子式:
D.氯乙烯分子的结构简式:H3C-CH2Cl
难度: 中等查看答案及解析
-
由反应物X分别转化为Y和Z的能量变化如图所示。下列说法正确的是( )
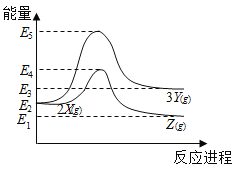
A. 由X→Y反应的ΔH=E5-E2 B. 由X→Z反应的ΔH>0
C. 降低压强有利于提高Y的产率 D. 升高温度有利于提高Z的产率
难度: 中等查看答案及解析
-
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是
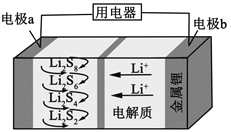
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e−=3Li2S4
B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中Li2S2的量越多
难度: 困难查看答案及解析
-
已知异丙苯的结构简式如图,下列说法错误的是
A.异丙苯的分子式为
B.异丙苯的沸点比苯高
C.异丙苯中碳原子可能都处于同一平面
D.异丙苯和苯为同系物
难度: 中等查看答案及解析
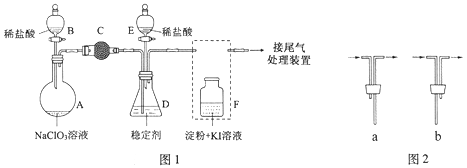
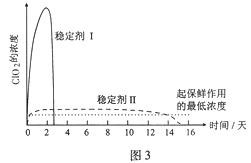
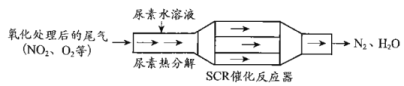
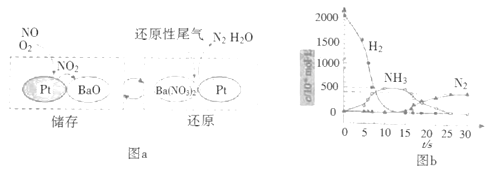

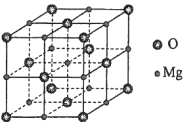
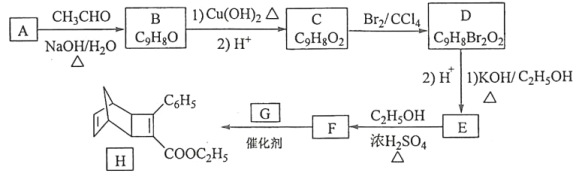
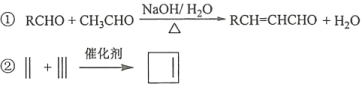
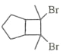 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。