-
2020年1月武汉爆发新冠肺炎,湖北省采取封城封镇的措施阻止了冠状病毒蔓延。新冠病毒主要传播方式是经飞沫传播、接触传播(包括手污染)以及不同大小的呼吸道气溶胶近距离传播。冠状病毒对热敏感,56℃30分钟、75%酒精、含氯消毒剂、过氧乙酸、乙醚和氯仿等脂溶剂均可有效灭活病毒。下列有关说法正确的是
A.因为过氧乙酸能灭活病毒,所以在家每天进行醋熏能杀死家里的新冠肺炎病毒
B.在空气质量检测中的PM2.5,属于气溶胶
C.电解食盐水制取次氯酸钠喷洒房间能杀死新冠肺炎病毒
D.含氯消毒剂、过氧乙酸、乙醚和氯仿等都属于有机物
难度: 简单查看答案及解析
-
通常监测SO2含量是否达到排放标准的反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl。设NA表示阿伏加德罗常数的值,下列说法正确的是
A.17gH2O2中含有非极性键数目为0.5NA
B.25℃时,pH=1的HCl溶液中含有H+的数目为0.1NA
C.0.1molBaCl2晶体中所含离子总数为0.2NA
D.生成2.33gBaSO4沉淀时,转移电子数目为0.01NA
难度: 中等查看答案及解析
-
在抗击新冠肺炎的过程中,科研人员研究了法匹拉韦、利巴韦林、氯硝柳胺等药物的疗效,三种药物主要成分的结构简式如下。下列说法不正确的是
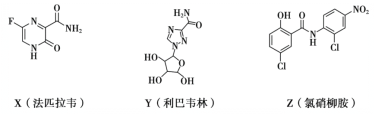
A.X的分子式为C5H4O2N3F
B.Z中含有6种官能团
C.Y和Z都有羟基,但性质不完全相同
D.X和Z都能发生加成反应和水解反应
难度: 中等查看答案及解析
-
下列实验操作正确且能达到相应实验目的的是
实验目的
实验操作
A
称取2.0gNaOH固体
先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体
B
配制FeCl3溶液
将FeCl3固体溶解于适量蒸馏水
C
检验溶液中是否含有NH4+
取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
D
验证铁的吸氧腐蚀
将铁钉放入试管中,用盐酸浸没
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中正确的是
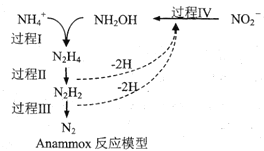
A.1molNH4+所含的质子总数为10NA(设NA为阿伏加德罗常数的值)
B.该方法每处理1molNH4+,需要0.5molNO2-
C.过程IV中,NO2-发生氧化反应
D.N2H2中含有σ键和π键
难度: 中等查看答案及解析
-
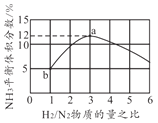
短周期元素W、X、Y、Z的原子序数依次增大。其中X与Y可形成一种淡黄色物质P,常温下将0.05 mol P溶于水,配成1L溶液,pH=13;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色物质和一种黑色物质。下列说法错误的是
A.简单离子半径:X>Y> Z
B.气态氢化物的稳定性:W>X
C.单质的熔点:Z>Y
D.元素Z形成的单质被称为“国防金属”
难度: 中等查看答案及解析
-
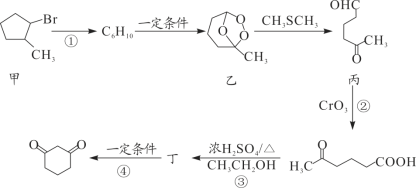
已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得,下列说法中正确的是

A.两分子苹果酸的一种缩合产物是:
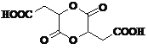
B.1mol雷琐苯乙酮最多能与3mol氢气发生加成反应
C.1mol产物伞形酮与溴水反应,最多可消耗3molBr2,均发生取代反应
D.反应中涉及到的三种有机物都能跟FeCl3溶液发生显色反应
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项
实验
现象
结论
A
铁的氢氧化物溶于足量HI溶液中,滴加KSCN溶液
固体溶解,溶液未变红色
铁的氢氧化物一定为
Fe(OH)2
B
向硝酸钡溶液中通入SO2
产生白色沉淀
硝酸钡溶液与SO2反应生 成BaSO3白色沉淀
C
铜丝在酒精灯外焰灼烧,再将赤热 铜丝插入酒精灯内焰
铜丝由红色变黑色, 再变红色
乙醇具有还原性
D
浓度均为 0.lmol·L-1 的 CuCl2,FeCl3 混合溶液中滴加0.lmol∙L-1NaOH溶液
先生成红褐色沉淀
氧化性:Fe3+>Cu2+
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
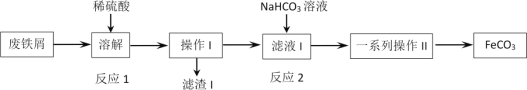
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
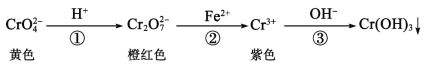
已知:转化过程中的反应为2CrO42-(aq)+2H+(aq)
Cr2O72-(aq)+H2O(l)。常温下Ksp[Cr(OH)3]=1×10-32。下列说法错误的是( )
A.反应①v正(CrO42-)=2v逆(Cr2O72-)时,反应处于平衡状态
B.反应②转移0.6mole-,则有0.2mol Cr2O72-被还原
C.除去废水中含铬离子的过程包括氧化还原反应和复分解反应
D.常温下,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,反应③应调溶液pH=5
难度: 中等查看答案及解析
-
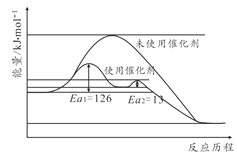
以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。下列说法正确的是
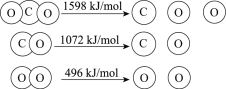
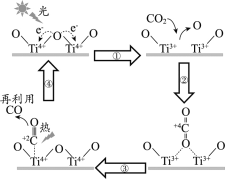
A.过程①中钛氧键断裂会释放能量
B.CO2分解反应的热化学方程式为2CO2(g)=2CO(g)+O2(g)ΔH=+30kJ/mol
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.该反应中,光能和热能转化为化学能
难度: 中等查看答案及解析
-
“空气吹出法”海水提溴的工艺流程如图:
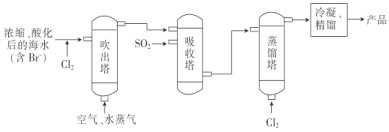
下列说法错误的是( )
A.进入吹出塔前,Br-被氧化为Br2
B.从吹出塔进入吸收塔的物质为混合物
C.蒸馏塔中只发生了物理变化
D.经过吸收塔后,溴元素得到富集
难度: 中等查看答案及解析
-
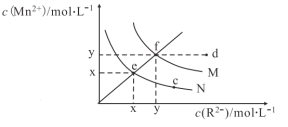
常温下,向1mol/LNH4Cl溶液中加入足量的镁条,该体系pH随时间变化的曲线如图所示。实验观察到b点开始溶液中有白色沉淀生成,已知Ksp[Mg(OH)2]=1.8×10−11。下列说法错误的是
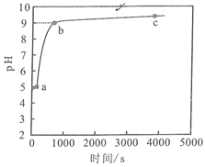
A.常温下,NH4Cl的水解平衡常数数量级为10−10
B.体系中,水的电离程度大小关系为
C.
点时,溶液中c(Mg2+)=0.18mol/L
D.a点溶液中,c(NH4+)+c(H+)<c(Cl−)+c(OH−)
难度: 中等查看答案及解析