-
下列有关水的说法中,不正确的是
A. 常用肥皂水来鉴别硬水和软水
B. 电解水中负极得到的氧气与正极得到的氢气的体积比为1:2
C. 活性炭净水器里,活性炭的作用是吸附,并过滤水中的不溶性杂质
D. 可用蒸馏的方法将自来水进一步净化
难度: 简单查看答案及解析
-
我国古代下列古代发明或技术中,主要原理涉及化学变化的是( )
A. 矿石炼铁 B. 水车灌溉 C. 活字印刷 D. 雕刻石像
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. 石墨具有导电性,可用于制铅笔芯
B. N2的化学性质不活泼,可用作保护气
C. NaCl溶液有咸味,可用于配制生理盐水
D. Ca(OH)2微溶于水,可用于改良酸性土壤
难度: 中等查看答案及解析
-
下列有关金属及合金的说法错误的是( )
A. 常温下所有的金属都是固体
B. 铁制品在潮湿的空气中易生锈
C. 生铁和不锈钢都是金属材料
D. 铝片表面易生成致密的氧化膜
难度: 简单查看答案及解析
-
燃烧前常将汽油(含C8H18等)喷成雾状,可以
A. 减少O2消耗量 B. 增大汽油与空气的接触面
C. 减少CO2生成量 D. 使C8H18等分子变得更小
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 分子是化学变化中的最小粒子 B. 不同元素的本质区别是电子数不同
C. 原子核由电子和质子构成 D. 墙内开花墙外香说明分子在不断运动
难度: 简单查看答案及解析
-
下列关于空气的说法正确的是
A.空气的主要成分是氮气和氧气
B.空气中的二氧化碳会造成酸雨
C.空气中的PM2.5 含量高说明空气质量好
D.洁净的空气是纯净物
难度: 简单查看答案及解析
-
生活中处处是化学。下列说法中不正确的是
A.用灼烧的方法可以鉴别羊毛和涤纶
B.铵态氮肥与熟石灰混合研磨后能嗅到刺激性气味
C.氯化钾和磷酸氢二铵[(NH4)2HPO4]都属于复合肥料
D.台灯的塑料底座属于有机合成材料
难度: 简单查看答案及解析
-
在配制氯化钠溶液过程中,可能导致溶质质量分数偏高的是
A.称量过程中砝码和氯化钠放反了托盘
B.装瓶时有少量溶液溅出
C.溶解过程中有少量水溅出
D.量筒量取水的体积时采用仰视读数
难度: 简单查看答案及解析
-
含氧元素质量相同的SO2和SO3,具有相同的
A.硫元素质量 B.二氧化硫和三氧化硫质量 C.氧原子个数 D.分子个数
难度: 中等查看答案及解析
-
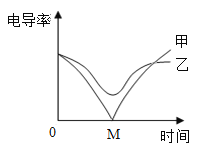
下列试剂中,能将Ca(OH)2、H2SO4、Na2SO4三种溶液一次鉴别出来的是
A.酚酞溶液 B.MgCl2溶液
C.Ba(OH)2溶液 D.Na2CO3溶液
难度: 中等查看答案及解析
-
化学学习者常用化学思维去认识和理解世界。下列选项正确的是
A.变化与守恒:物质X在氧气中燃烧后生成二氧化碳和水,可推测X中只含有C、H这2种元素
B.宏观与微观:CO和CO2虽然元素组成相同,但二者性质不同,原因是分子构成不同
C.模型与推理:中和反应有盐和水生成,则有盐和水生成的反应一定是中和反应
D.探究与创新:探究氧化铜是否为过氧化氢分解的催化剂,只需设计实验证明氧化铜能否改变反应速率即可
难度: 中等查看答案及解析
-
除去下列物质中少量杂质所选试剂和操作方法都正确的是
选项
物质
杂质
所用试剂
操作方法
A
Ag粉
Cu粉
AgNO3
过滤、洗涤、干燥
B
KCl固体
KClO3
少量二氧化锰
加热
C
H2SO4溶液
HCl溶液
适量Ag NO3溶液
过滤
D
NH3
水蒸气
浓硫酸
干燥
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
如图是某原子的核外电子排布图,以下说法正确的是
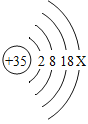
A.该原子的化学性质和氯原子相似
B.该粒子的相对原子质量是 35
C.该粒子容易失去电子
D.X 的数值为 5
难度: 简单查看答案及解析
-
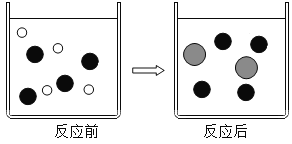
已知某两种物质在光照条件下能发生化学反应,其微观示意图如下(说明:一种小球代表一种元素的原子),则下列说法中正确的是( )
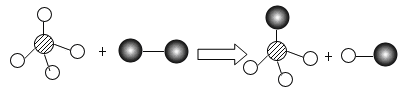
A.图示中的反应物都是化合物 B.该反应属于置换反应
C.该图示不符合质量守恒定律 D.图示中共有4种物质
难度: 中等查看答案及解析
-
25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是( )
编号
①
②
③
④
水的质量/g
50
50
50
50
加入固体质量/g
5
10
15
20
现象
固体完全溶解
固体完全溶解
剩余少量固体
剩余较多固体
A.实验①所得溶液的溶质质量分数是实验②的一半
B.在实验④中再加入50g 水后,溶液的溶质质量分数为15%
C.由表格中的数据可以确定 25℃时该物质的溶解度大小的范围是:20 g≤S<30g
D.实验②中温度由25℃冷却到10℃时,一定有固体析出
难度: 中等查看答案及解析
-
制造芯片的高纯硅(硅原子的质子数为14)可以用下述方法制取(反应条件略):
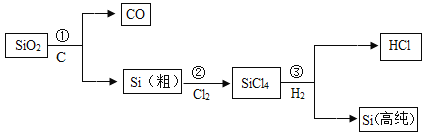
下列有关说法错误的是
A.硅原子在化学变化中容易得电子
B.SiCl4中Si的化合价为+4
C.反应①、③均为置换反应
D.硅原子的核电荷数为14
难度: 中等查看答案及解析
-
下列所示的四个图象能正确反映对应变化关系的是( )
A.
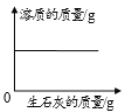 向一定量的饱和石灰水中不断加入生石灰
向一定量的饱和石灰水中不断加入生石灰B.
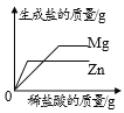 向等质量的镁和锌中加入稀盐酸至过量
向等质量的镁和锌中加入稀盐酸至过量C.
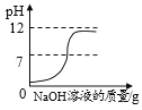 向pH=2的稀盐酸中加入pH=12的氢氧化钠溶液
向pH=2的稀盐酸中加入pH=12的氢氧化钠溶液D.
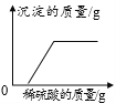 向一定量的氢氧化钾和氯化钡的混合溶液中滴加稀硫酸
向一定量的氢氧化钾和氯化钡的混合溶液中滴加稀硫酸难度: 中等查看答案及解析
-
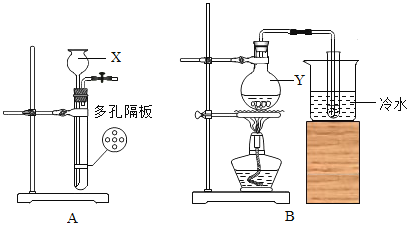
氢气和一氧化碳还原氧化铜的实验装置如下,说法不正确的是
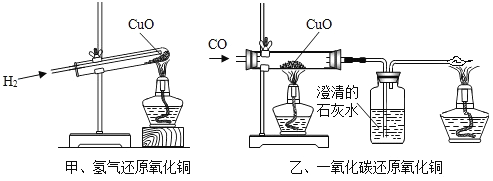
A.实验时都应该先通入气体一段时间后再加热,防止发生爆炸
B.甲试管略向下倾斜,乙玻璃管保持水平,主要是因为两种气体的密度不同
C.两者都可以通过观察黑色固体颜色的变化判断反应是否发生
D.乙中需尾气处理装置,是因为一氧化碳有毒
难度: 中等查看答案及解析
-
一定量甲烷(化学式:CH4)在氧气中不完全燃烧,生成一氧化碳、二氧化碳和水的分子个数之比可能为
A.1:1:2 B.2:1:4 C.2:3:6 D.3:1:8
难度: 中等查看答案及解析