-
下列叙述中正确的是
A.化学反应一定有物质变化,不一定有能量变化
B.化合反应一定是放热反应
C.放热反应不需要加热就一定能发生
D.吸热反应不加热也可能发生
难度: 简单查看答案及解析
-
热化学方程式C(s)+H2O(g) == CO(g)+H2(g);△H =+131.3kJ/mol表示
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成1mol一氧化碳气体和1mol氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
难度: 中等查看答案及解析
-
反应NH4HS(s)
NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是
A.温度、容积不变时,通入SO2气体
B.移走一部分NH4HS固体
C.容积不变,充入氨气
D.保持压强不变,充入氮气
难度: 简单查看答案及解析
-
下列关于平衡常数K的说法中,正确的是
A.在任何条件下,化学平衡常数是一个恒定值
B.改变反应物浓度或生成物浓度都会改变平衡常数K
C.平衡常数K只与温度有关,与反应浓度、压强无关
D.从平衡常数K的大小不能推断一个反应进行的程度
难度: 简单查看答案及解析
-
在恒温、恒容的容器中进行反应:2HI
H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为
A.等于10 s B.等于12 s C.大于12 s D.小于12 s
难度: 中等查看答案及解析
-
在恒温、恒容条件下,能使A(g)+B(g)
C(g)+D(g)正反应速率增大的措施是
A.减小C或D的浓度 B.增大D的浓度
C.减小B的浓度 D.增大A或B的浓度
难度: 简单查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g)(正反应吸热),下列图象正确的是

难度: 中等查看答案及解析
-
从下列事实所得出的解释或结论正确的是
选项
实验事实
解释或结论
A
2N2O5(g)=4NO2(g)+O2(g) ΔH>0
在室温下能自发进行
这是一个熵增的反应
B
压缩针筒内的NO2和N2O4混合气体,颜色先变深后变浅
增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小
C
锌与稀硫酸反应过程中,开始反应后,速率逐渐增大
该反应是吸热反应
D
已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动
反应物的浓度一定降低
难度: 简单查看答案及解析
-
下列说法或表示方法中正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石)→C(石墨)ΔH= -1.9KJ/mol 可知,金刚石比石墨稳定
C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8KJ/mol
D.向纯水中加入硫酸氢钠,水的电离程度减小,Kw值不变。
难度: 中等查看答案及解析
-
在一定条件下,对于A2(g)+3B2(g)
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A.v(A2)=0.8 mol·L-1·s-1 B.v(A2)=30 mol·L-1·min-1
C.v(AB3)=1.0 mol·L-1·s-1 D.v(B2)=1.2 mol·L-1·s-1
难度: 简单查看答案及解析
-
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法,其中正确的是
① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·S-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·L-1·S-1
③ 2 s 时物质 A 的转化率为70%
④ 2 s 时物质 B 的浓度为 0.7 mol·L-1,
A、①③ B、①④ C、②③ D、③④
难度: 中等查看答案及解析
-
在反应aA+bB
cC的平衡体系中,无论升高温度或增加压强,C的浓度都会增大,则以下说法正确的是
A.a+b<c 正反应吸热 B.a+b>c 正反应吸热
C.a+b>c 正反应放热 D.无法确定系数关系 正反应吸热
难度: 中等查看答案及解析
-
在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g)
2C(g);△H<0。若起始温度相同,分别向三个容器中通入3molA和1mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为
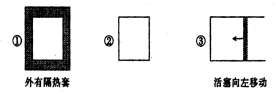
A.③②① B.②①③ C.①②③ D.③①②
难度: 困难查看答案及解析
-
室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s) △CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是
A、△H2>△H3 B、△H1<△H3
C、△H1+△H3 =△H2 D、△H1+△H2 >△H3
难度: 中等查看答案及解析
-
相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是


难度: 中等查看答案及解析
-
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.溶液中
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加10 mL pH=11的NaOH溶液,混合液pH=7
难度: 中等查看答案及解析
-
某温度下,体积一定的密闭容器中进行如下可逆反应
X(g)+Y(g)
Z(g)+W(s);ΔH>0下列叙述正确的是
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.平衡后加入X,上述反应的ΔH增大
难度: 中等查看答案及解析
-
可逆反应a A(s)+b B(g)
c C(g)+d D(g),反应过程中,当其它条件不变时,C 的百分含量(C%)与温度(T)和压强(P)的关系如下图下列叙述正确的是

A.达平衡后,加入催化剂则C%增大
B.达平衡后,若升温,平衡左移
C.化学方程式中b >c +d
D.达平衡后,增加A的量有利于平衡向右移动
难度: 中等查看答案及解析
-
右图是关于反应A2(g)+3B2(g) = 2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是

A.升高温度,同时加压。
B.降低温度,同时减压
C.增大反应物浓度,同时使用催化剂;
D.增大反应物浓度,同时减小生成物浓度
难度: 中等查看答案及解析
-
在一定温度下,下列叙述不是可逆反应A(g)+3B(g)
2C(g)达到平衡的标志的是
(1)C的生成速率与C的分解速率相等;
(2)单位时间内amol A生成,同时生成3amol B;
(3)A、B、C的浓度不再变化;
(4)混合气体的总压强不再变化;
(5)混合气体的物质的量不再变化;
(6)单位时间消耗amol A,同时生成3amol B;
(7)A 、B、C的分子数目比为1:3:2。
A.(2)(5) B.(1)(3) C.(2)(7) D.(5)(6)
难度: 中等查看答案及解析
-
某温度下在密闭容器中发生如下反应3 M(g)+ N(g)
2G(g)
若开始时只充入2molG(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入3 molM和1molN的混合气体,达平衡时M的转化率为
A.20% B.40% C.60% D. 80%
难度: 中等查看答案及解析
-
在密闭容器中发生如下反应:mA(g)+nB(g)
pC(g)达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍。下列说法中正确的是
A、m+n>p B、平衡向逆反应方向移动
C、A的转化率增大 D、C的体积分数增加
难度: 中等查看答案及解析
-
一定条件下,可逆反应N2 +3H2
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
A、加催化剂,V正、V逆 都发生变化,且变化的倍数相等
B、加压,V正、V逆 都增大,且V正 增大的倍数大于V逆 增大的倍数
C、降温,V正、V逆 都减小,且V正 减小的倍数大于V逆 减小的倍数
D、增大氮气的浓度,V正增大、V逆 不变,N2 转化率减小,H2转化率增大
难度: 简单查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是
A.△H1>△H2>△H3 B.△H1<△H3<△H2
C.△H1<△H2<△H3 D.△H1>△H3>△H2
难度: 中等查看答案及解析
-
下列事实中,不能用勒夏特列原理解释的是
A.对熟石灰的悬浊液加热,悬浊液中固体质量增加
B.实验室中常用排饱和食盐水的方式收集氯气
C.打开汽水瓶,有气泡从溶液中冒出
D.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
难度: 中等查看答案及解析
-
分析下表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是
“嫦娥一号”发射火箭燃料
液氢(H2)
①2H2(g)+O2(g)
2H2O(l) ΔH=-571.6 kJ·mol-1
②2H2 (l)+O2(l)
2H2O(g) ΔH=-482.6 kJ·mol-1
北京奥运“祥云”火炬燃料
丙烷
(C3H8)
③C3H8 (l)+5O2(g)
3CO2(g)+4H2O(g) ΔH=-2 013.8 kJ·mol-1
④C3H8(g)+5O2(g)
3CO2(g)+4H2O(l) ΔH=-2 221.5 kJ·mol-1
A.571.6 kJ·mol-1,2 221.5 kJ·mol-1
B.241.3 kJ·mol-1,2 013.8 kJ·mol-1
C.285.8 kJ·mol-1,2 013.8 kJ·mol-1
D.285.8 kJ·mol-1,2 221.5 kJ·mol-1
难度: 简单查看答案及解析

 2Cl2+2H2O
2Cl2+2H2O