-
朱自清在《荷塘月色》冲写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的班驳的黑影……”月光穿过薄雾形成的种种美景本质原因是
A. 空气中的小水滴颗粒直径大小约为1nm--100nm
B. 空气中的小水滴颗粒的布朗运动
C. 雾是一种胶体,胶粒带相同电荷
D. 发生丁达尔效应
难度: 简单查看答案及解析
-
将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s) + 2Cl2(g)=TiCl4(l) + O2(g) △H=+140.5 kJ/mol
C(s,石墨) + 1/2O2(g)=CO(g) △H=-110.5 kJ/mol
则反应TiO2(s) + 2Cl2(g) + 2C(s,石墨)=TiCl4(l) + 2CO(g) 的△H是
A. +80.5 kJ/mol B. +30.0 kJ/mol C. -30.0 kJ/mol D. -80.5 kJ/mol
难度: 中等查看答案及解析
-
“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是
A. 蚕丝的主要成分是蛋白质
B. 蚕丝属于天然高分子材料
C. “蜡炬成灰”过程中发生了氧化反应
D. 古代的蜡是高级脂肪酸酯,属于高分子聚合物
难度: 简单查看答案及解析
-
相同温度下,等物质的量浓度的下列溶液中,pH最小的是( )
A.NH4HSO4 B.NH4HCO3 C.NH4Cl D.(NH4)2SO4
难度: 中等查看答案及解析
-
已知某温度下纯水中的c(H+)=2×10-7mol/L,对此下列说法正确的是( )
A.若向水中加入少量盐酸,则水的电离度减小
B.该温度低于25℃
C.此温度下水的离子积为常温下的两倍
D.据此无法求算水中c(OH-)
难度: 简单查看答案及解析
-
已知NA是阿伏加德罗常数的值,下列说法错误的是
A. 3g 3He含有的中子数为1NA
B. 1 L 0.1 mol·L−1磷酸钠溶液含有的
数目为0.1NA
C. 1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D. 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA
难度: 中等查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是 ( )
A.强碱性溶液中: K+、Al3+、Cl-、SO42-
B.由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,Na+、K+、Cl-、HCO3-
C.强碱性的溶液中:CO32-、Na+、AlO2-、NO3-
D.酸性溶液中:Fe2+、Al3+、NO3-、I-
难度: 中等查看答案及解析
-
类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中,正确的是( )
A.由2Cu + O2
2CuO可推出同族的硫也有Cu + S
CuS
B.Fe3O4可表示为FeO·Fe2O3,则Pb3O4可表示为PbO·Pb2O3
C.Na能与水反应生成H2,K、Ca也能与水反应生成H2
D.CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2
难度: 简单查看答案及解析
-
当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)
Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的( )
A.MgCl2 B.NaOH C.MgSO4 D.H2SO4
难度: 简单查看答案及解析
-
下列水解化学方程式或水解离子方程式正确的是 ( )
A.NH4+ + H2O = NH3·H2O + H+ B.CH3COO— + H2O
CH3COOH + OH—
C.CH3COOH + NaOH
CH3COONa + H2O D.NaCl + H2O
NaOH + HCl
难度: 简单查看答案及解析
-
X、Y、Z、W、M均为短周期元素,X、Y同主族,X的氢化物和最高价氧化物的水化物能反应生成一种离子化合物,其水溶液显酸性;Z、W、M是第3周期连续的三种元素,其中只有一种是非金属,且原子半径Z>W>M。下列叙述准确的是 ( )
A.X、M两元素氢化物的稳定性:X<M
B.Z、W、M的单质均能与稀硫酸反应制取氢气,但反应剧烈程度依次减弱
C.Z是海水中含量最高的金属元素,W是地壳中含量最多的金属元素
D.W和M的氧化物均可做耐高温材料
难度: 中等查看答案及解析
-
在一密闭容器中,反应 aA(g)
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则 ( )
A.物质B的质量分数减小了 B.平衡向逆反应方向移动了
C.平衡向正反应方向移动了 D.a>b
难度: 简单查看答案及解析
-
将pH试纸用蒸馏水湿润后,去测定某溶液的pH值,该溶液的pH值将会
A.偏高 B.偏低 C.不变 D.上述三种情况均有可能
难度: 简单查看答案及解析
-
下列化学方程式中,不能正确表达反应颜色变化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2
CaCO3↓+H2O
C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2
2Na2O+O2↑
D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3
2Fe(OH)3+3MgCl2
难度: 中等查看答案及解析
-
下列判断中,正确的是( )
A.升高温度,Al2(SO4)3溶液的pH增大
B.在Na2CO3溶液中:c(OH-)- c(H+)= c(HCO3-) + 2c(H2CO3)
C.室温下,CuSO4溶液pH<7,因此向纯水中加入CuSO4会抑制水的电离
D.在CH3COONa溶液中,各离子的浓度由大到小的顺序是c(Na+) >c(CH3COO-) >c(H+)>c(OH-)
难度: 简单查看答案及解析
-
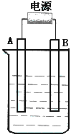
下图是两套电能与化学能相互转化的装置。对此两套装置 的分析正确的是

A.图1装置中的铁电极发生还原反应
B.图2装置反应一段时间后溶液的pH会降低
C.两装置中石墨电极上所产生的气体都是H2
D.两装置都可用于防止铁被腐蚀
难度: 简单查看答案及解析