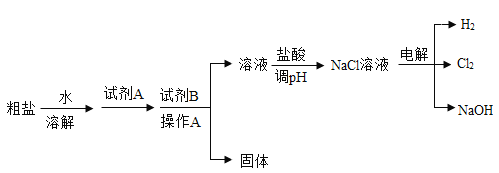
-
下列选用试剂和实验操作都正确的是(括号内物质为杂质)
选项
物质
除杂试剂(足量)
操作方法
A
CO2(CO)
氧化铜
气体通过灼热的氧化铜
B
K2CO3(KCl)
稀盐酸
加入稀盐酸、蒸发、结品
C
FeSO4(CuSO4)
锌粉
加入锌粉,过滤
D
Zn(Fe)
稀硫酸
稀硫酸,过滤
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某同学在做加热氯酸钾抽取氧气的实验中,错把高锰酸钾当成二氧化锰加入氯酸钾中,下列说法正确的是
A.高锰酸钾是氯酸钾分解的催化剂
B.反应速率加快,生成氧气的量增加
C.反应速率加快,生成氧气的量不变
D.很难反应,几乎收集不到氧气
难度: 简单查看答案及解析
-
某气体可能由初中化学中常见的一种或多种气体组成,经测定其中只含有碳、氧两种元素,质量比为1:2,则关于该气体的正确说法是( )
A. 一定是纯净物
B. 一定是CO和CO2的混合物
C. 该气体最多的可能组成的2种
D. 该气体最多的可能组成有3种
难度: 中等查看答案及解析
-
现取2.3g某有机物在空气中完全燃烧,生成4.4g二氧化碳和2.7g水。对该物质的组成有下列推断:①一定含碳氢元素 ②一定不含氧元素 ③可能含氧元素 ④一定含氧元素 ⑤分子中C、H的原子个数比为2∶5 ⑥分子中C、H、O的元素质量比为12∶3∶8。其中正确的是( )
A.①③⑤ B.①④⑥ C.①②⑤ D.①④⑤
难度: 中等查看答案及解析
-
工业上,高温煅烧石灰石可制取生石灰(
)。现有100g CaCO3样品,高温锻烧一段时间后,剩余固体的质量为67g。下列推断不符合客观事实的是
A.反应后固体质量减少的原因是逸出了二氧化碳气体
B.生成物中CaO的质量是42g
C.剩余固体中钙元素的质量分数大于40%
D.剩余固体中碳元素与氧元素的质量之比大于1:4
难度: 困难查看答案及解析
-
CaCO3高温加热可以生成CaO和CO2气体,现取一定质量的CaCO3高温加热一段时间,冷却,测得剩余固体的质量为8.0克,剩余固体中钙元素的质量分数为50%。下列判断正确的是
A.生成2.0克的CO2
B.原来CaCO3为14.2克
C.生成了5.6克的CaO
D.剩余CaCO3的质量为3.0克
难度: 困难查看答案及解析
-
宏观、微观、符号相结合是化学学科特有的思维方式。工业上常将煤洗选加工后用于制备水煤气,其主要反应的微观示意图如下:
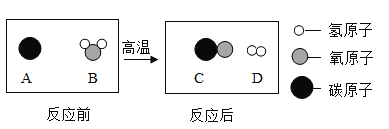
下列说法不正确的是
A. 物质C是由碳、氧两种元素组成的;
B. 该反应前后原子的种类没有发生变化
C. 该反应前后各元素化合价都没有变化
D. 该反应的化学方程式为C+H2O
CO+H2
难度: 中等查看答案及解析
-
在一定条件下,一密闭容器内发生某反应,测得反应前后备物质的质量如下表所示,下列说法错误的是( )
物质
a
b
c
d
反应前的质量/g
30
5
10
15
反应后的质量/g
x
y
20
20
A.b一定是反应物 B.x+y=20
C.a一定是反应物 D.反应中c与d的质量变化之比为2:1
难度: 中等查看答案及解析
-
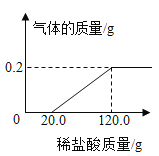
下列四个图像分别表示四个化学兴趣小组活动中的数据及处理情况,其中正确的是
A.
加热一定质量的高锰酸钾固体
B.
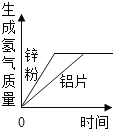 相同质量的铝片和锌粉分别放入到足量的稀硫酸中
相同质量的铝片和锌粉分别放入到足量的稀硫酸中C.
一定量的硫酸铜溶液中加入铁片
D.
一定量的石灰石加入到足量的稀盐酸中(不考虑水、氯化氢的挥发)
难度: 中等查看答案及解析