-
能正确表示下列反应的离子方程式是
A. 在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O
B. NH4HCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-
C. 氢氧化亚铁溶于稀硝酸中:Fe(OH)2+2H+=Fe2++2H2O
D. 澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
难度: 困难查看答案及解析
-
下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
A
B
C
D
能屏蔽电磁波的
碳包覆银纳米线
2022年冬奥会
聚氨酯速滑服
4.03米大口径
碳化硅反射镜
“玉兔二号”
钛合金筛网轮
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
NA是阿伏加德罗常数的值,下列说法不正确的是
A.5.5g超重水(T2O)中含有的中子数目为3NA
B.常温常压下,44gCO2与足量过氧化钠反应转移电子的数目为NA
C.常温常压下,42gC2H4和C4H8混合气体中含有氢原子的数目为6NA
D.0.1L0.5mol·L-1CH3COOH溶液中含有H+数目为0.2NA
难度: 简单查看答案及解析
-
2012年,国际纯粹与应用化学联合会(IUPAC)宣布第116号元素命名为鉝(Livermorium),元素符号是Lv,以纪念劳伦斯利弗莫尔国家实验室(LLNL)对元素发现作出的贡献。下列有关叙述中不正确的是
①Lv的非金属性比S强 ②Lv元素原子的内层电子共有110个 ③Lv是过渡金属元素 ④Lv元素原子的最高价氧化物对应的水化物为强酸 ⑤Lv元素的最高价氧化物的化学式为LvO3
A.①③④ B.①②④ C.③⑤ D.②⑤
难度: 简单查看答案及解析
-
下列实验现象与实验操作不相匹配的是
实验操作
实现现象
A
分别向两只盛有等体积等浓度的稀硫酸烧杯中加入打磨过的同样大小的镁片和铝片
镁片表面产生气泡较快
B
向试管中加入2mL5%的硫酸铜溶液,再逐滴加入浓氨水至过量,边滴边振荡
逐渐生成大量蓝色沉淀,沉淀不溶解
C
将镁条点燃后迅速伸入集满二氧化碳的集气瓶
集气瓶中产生浓烟并有黑色颗粒产生
D
向盛有氯化铁溶液的试管中加过量铁粉,充分振荡后加2—3滴KSCN溶液
黄色逐渐消失,加KSCN后溶液颜色不变
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
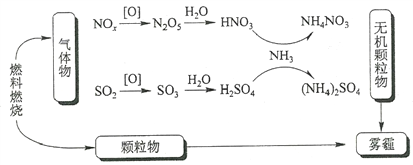
A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
难度: 简单查看答案及解析
-
第三周期的下列基态原子中,第一电离能最小的是
A.3s23p3 B.3s23p5 C.3s23p4 D.3s23p6
难度: 简单查看答案及解析
-
硫元素最常见和最稳定的一种同素异形体是黄色的正交α-型,1912年E.Beckmann由硫在碘中的冰点降低法测得它含有S8分子。1891年,M.R.Engel用浓盐酸和硫代硫酸盐的饱和溶液在0℃下作用首次制得了一种菱形的
-硫,后来证明含有S6分子。下列说法正确的是
A.S6和S8分子都是由S原子组成,所以它们是一种物质
B.S6和S8分子分别与铁粉反应,所得产物不同
C.S6和S8分子分别与过量的氧气反应可以得到SO3
D.等质量的S6和S8分子分别与足量的KOH反应,消耗KOH的物质的量相同
难度: 简单查看答案及解析
-
NH3、H2S等是极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子。根据上述实例可以推测出AB2型分子为非极性分子的经验规律是
A.分子中必须含有π键 B.在ABn分子中A原子没有孤对电子
C.在ABn分子中不能形成分子间氢键 D.分子中每个共价键的键长应相等
难度: 中等查看答案及解析
-
草酸亚铁(FeC2O4)可作为生产电池正极材料磷酸铁锂的原料,受热容易分解,为探究草酸亚铁的热分解产物,按下面所示装置进行实验。

下列说法不正确的是
A.实验中观察到装置B、F中石灰水变浑浊,E中固体变为红色,则证明分解产物中有CO2和CO
B.反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,证明分解产物中不含Fe2O3
C.装置C的作用是除去混合气中的CO2
D.反应结束后,应熄灭A,E处酒精灯后,持续通入N2直至温度恢复至室温
难度: 简单查看答案及解析
-
如图所示是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c,d均是热和电的良导体。下列说法不正确的是
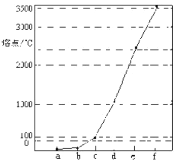
A.e、f单质晶体熔化时克服的是共价键
B.d单质对应元素原子的电子排布式:1s22s22p63s23p2
C.b元素形成的气态氢化物易与水分子之间形成氢键
D.单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含2个σ键,2个π键
难度: 简单查看答案及解析