-
某水溶液中含有等物质的量的Cu2+、Cl-、H+、SO42-,该溶液放在电解槽中,下列说法正确的是
A.用石墨做电极时,首先在阴极放电的是Cl-
B.用石墨做电极时,电解一段时间后H+有可能在阴极放电
C.用铁做电极时,阳极反应式:2Cl-—2e—=Cl2↑
D.用石墨做电极时,开始电解时Cl-与H+首先放电
难度: 中等查看答案及解析
-
在相同温度时,100mL0.01mol·L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数值中,前者大于后者的是
A.H+的物质的量 B.醋酸的电离常数
C.中和时所需NaOH的量 D.CH3COOH的物质的量
难度: 中等查看答案及解析
-
下列溶液一定呈中性的是
A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L溶液
C.使石蕊试液呈紫色的溶液 D.酸与碱恰好完全反应生成正盐的溶液
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Na+、MnO-4、SO2-4
②pH=11的溶液中:CO2-3、Na+、AlO-2、NO-3
③加入Al能放出H2的溶液中:Cl-、HCO-3、SO2-4、NH+4
④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br一
⑤有较多Fe3+的溶液中:Na+、H+、SCN-、HCO-3
⑥酸性溶液中:Fe2+、Al3+、NO-3、I- 、Cl—
A.①② B.③⑥ C.②④ D.⑤⑥
难度: 中等查看答案及解析
-
下列生产、生活等实际应用,不能用勒夏特列原理解释的是
A.实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸
B.合成氨工业中使用铁触媒做催化剂
C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体
D.热的纯碱溶液去油污效果好
难度: 中等查看答案及解析
-
叠氮酸(HN3)与醋酸酸性相似,下列叙述中一定错误的是
A. HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N)>c(OH-)
B. HN3与NH3作用生成的叠氮酸铵是共价化合物
C. NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N)>c(OH-)>c(H+)
D. N与CO2含相等电子数
难度: 中等查看答案及解析
-
一定条件下,存在可逆反应X(g)+2Y(g)
3Z(g),若X、Y、Z起始浓度分别为
(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.2mol/L,0.06mol/L,则下列判断不合理的是
A.
=l:2
B.达平衡状态时,生成Z的速率是生成X速率的3倍
C.X、Y的转化率不相等
D.C2的取值范围为
难度: 中等查看答案及解析
-
Li—Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-==Li2S+Fe。有关该电池的下列叙述中正确的是
A.Li—Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为2 Li+FeS =Li2S+Fe
C.负极的电极反应式为Al-3e-===Al3+
D.充电时,阴极发生的电极反应式为Li2S+Fe-2e-===2Li++FeS
难度: 中等查看答案及解析
-
相同温度度,体积均为0.25L的两个恒容容器中发生可逆反应:X2(g)+3Y2(g)
2XY3(g)△H=-92.6kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器编号
起始时各物质物质的量/mol
达平衡时体系能量的变化
X2
Y2
XY3
①
1
3
0
放热46.3 kJ
②
0.8
2.4
0.4
Q(Q>O)
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.容器①、②中达到平衡时各物质的百分含量相同
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20L.则达平衡时放出的热量大于46.3kJ
难度: 中等查看答案及解析
-
欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32¯)、c(HCO3¯)都减少,其方法是
A.加水 B.加入氢氧化钠固体
C.通入氯化氢气体 D.加入饱和石灰水溶液
难度: 中等查看答案及解析
-
氢氧化镁固体在水中溶解,有下列平衡:Mg(OH)2(s)
Mg2++ 2OH―,加入下列哪种固体物质可使Mg(OH)2固体的质量减少
A.Na2CO3 B.MgCl2 C.NH4Cl D.NaCl
难度: 中等查看答案及解析
-
有关①100ml 0.1 mol/L
、②100ml 0.1 mol/L
两种溶液的叙述不正确的是
A.溶液中水电离出的
个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:
D.②溶液中:
难度: 中等查看答案及解析
-
在相同温度下,有相同体积的甲、乙两容器,甲容器中充入1g N2和1g H2,乙容器中充入2g N2和2g H2。下列叙述中,错误的是
A.化学反应速率:乙>甲 B.平衡后N2的浓度:乙>甲
C.H2的转化率:乙>甲 D.平衡混合气中H2的体积分数:乙>甲
难度: 中等查看答案及解析
-
观察下图装置,其中a、b是两根石墨棒,有关电极反应式错误的是
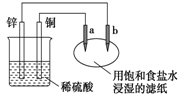
A.a电极:2Cl-—2e—=Cl2↑ B.b电极:2H++2e—=H2↑
C.铜电极:2H++2e—=H2↑ D.锌电极:4OH-—4e—=2H2O+O2↑
难度: 中等查看答案及解析
-
将等体积的0.1 mol·L-1 KHSO4溶液逐滴加入0.1 mol·L-1的Na2SO3溶液中,所得溶液能使紫色石蕊试液变红,则下列各离子浓度关系中不正确的是
A.c(SO)>c(SO)>c(H+)>c(OH-)
B.c(Na+)>c(K+)>c(H+)>c(OH-)
C.c(Na+)=c(SO)+c(H2SO3)+c(HSO)+c(SO)
D.c(Na+)+c(K+)+c(H+)=2c(SO)+c(HSO)+c(OH-) +2c(SO)
难度: 困难查看答案及解析
-
按下图装置进行电解(均是惰性电极),已知A烧杯中装有500 mL20%的NaOH溶液,B烧杯中装有500 mL pH为6的1 mol·L-1CuSO4溶液。通电一段时间后,在b电极上收集到28mL气体(标准状况),则B烧杯中溶液pH变为(溶液体积变化忽略不计)
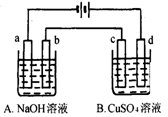
A.4 B.3 C.2 D.1
难度: 中等查看答案及解析
-
在水中加入等物质的量的Ag+、Ba2+、SO42-、NO3-、Cl-、Na+,用惰性材料作电极进行电解,通电片刻后停止,下列说法不正确的是
A.电解的实质是:阳极:2Cl--2e-==Cl2↑;阴极:Ag+e-==Ag
B.电解的实质是:阳极:4OH--4e-==2H2O+O2↑;阴极:2H++2e-==H2↑
C.要恢复成电解前的溶液可以加水
D.电解产物中氧化产物和还原产物的物质的量之比为1∶2
难度: 中等查看答案及解析
-
有五瓶溶液分别是①10mL0.60mol/LNaOH水溶液 ②20mL0.50mol/L硫酸水溶液 ③30mL0.40mol/LHCl溶液 ④40mL0.30mol/LHAc水溶液 ⑤50mL0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是
A.①>②>③>④>⑤ B.②>①>③>④>⑤
C.②>③>④>①>⑤ D.⑤>④>③>②>①
难度: 中等查看答案及解析
-
反应CO(g)+H2O(g)
CO2(g)+H2(g) ΔH=-41.2kJ·mol-1,在800℃时的化学平衡常数K=1.0。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO
H2O
CO2
H2
0.5 mol
8.5 mol
2.0 mol
2.0 mol
此时反应中正、逆反应速率的关系式是
A.v(正)>v(逆) B.v(正)<v(逆)
C.v(正)=v(逆) D.无法判断
难度: 中等查看答案及解析
-
常温下,用 0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L
溶液所得滴定曲线如下图。下列说法正确的是
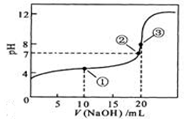
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
难度: 困难查看答案及解析