-
向四支试管中分别加入少量不同的无色溶液并进行如下操作,其中结论正确的是
选项
操作
现象
结论
A
滴加BaCl2溶液
生成白色沉淀
原溶液中有SO42—
B
滴加氯水和CCl4,振荡、静置
下层溶液显紫红色
原溶液中有I-
C
用洁净的铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+、无K+
D
滴加几滴稀NaOH溶液,将湿润的红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知:C(s)+ H2O(g)== CO(g) + H2(g) △H = a kJ·mol-1
2 C(s)+ O2(g)== 2CO(g) △H = -220 kJ·mol-1
H-H 、O=O和O-H键的键能(kJ·mol-1)分别为436、496和462,则a为( )
A.-332 B.-118 C.+350 D.+130
难度: 中等查看答案及解析
-
CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应:NH3+CO2→
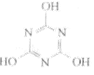 +H2O,下列有关三聚氰胺的说法正确的是
+H2O,下列有关三聚氰胺的说法正确的是A.分子式为C3H6N3O3
B.属于共价化合物
C.分子中既含极性键,又含非极性键
D.生成该物质的上述反应为中和反应
难度: 中等查看答案及解析
-
下列电池工作时,O2在正极放电的是( )




A.锌锰电池
B.氢燃料电池
C.铅蓄电池
D.镍镉电池
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
某反应过程能量变化如图所示,下列说法正确的是
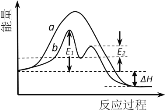
A.反应过程a有催化剂参与
B.该反应为吸热反应,热效应等于∆H
C.改变催化剂,可改变该反应的活化能
D.有催化剂的条件下,反应的活化能等于E1+E2
难度: 简单查看答案及解析
-
“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是( )
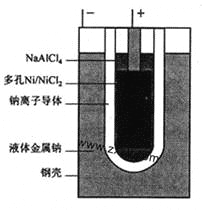
A.电池反应中有NaCl生成
B.电池的总反应是金属钠还原三价铝离子
C.正极反应为:NiCl2+2e-=Ni+2Cl-
D.钠离子通过钠离子导体在两电极间移动
难度: 简单查看答案及解析
-
已知:SO32—+I2+H2O===SO42—+2H++2I-,某溶液中可能含有I-、NH4+、Cu2+、SO32—,向该无色溶液中加入少量溴水,溶液仍呈无色,下列判断正确的是( )
A. 肯定不含I- B. 肯定不含NH4+ C. 可能含有SO32— D. 可能含有I-
难度: 困难查看答案及解析
-
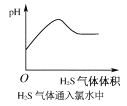
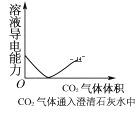
下列实验过程中,产生现象与对应的图形相符合的是( )
A.NaHSO3粉末加入HNO3溶液中
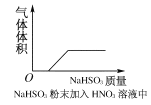
B.H2S气体通入氯水中
C.NaOH溶液滴入Ba(HCO3)2溶液中
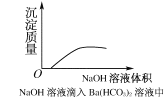
D.CO2气体通入澄清石灰水中
难度: 中等查看答案及解析
-
下列除杂方案错误的是
选项
被提纯的物质
杂质
除杂试剂
除杂方法
A
CO2(g)
SO2(g)
饱和NaHCO3溶液、浓H2SO4
洗气
B
NH4Cl(aq)
FeCl3(aq)
NaOH溶液
过滤
C
CH4(g)
CO2(g)
NaOH溶液、浓H2SO4
洗气
D
FeCl2 (aq)
CuCl2 (aq)
铁粉
过滤
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
关于下图所示各装置的叙述中,正确的是

A.装置①是原电池,总反应是:Cu + 2Fe3+= Cu2++ 2Fe2+
B.装置①中,铁做负极,电极反应式为:Fe3++ e-= Fe2+
C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
难度: 中等查看答案及解析
-
肼(N2H4)是一种高效清洁的火箭燃料。25℃、101kPa时,0.25molN2H4(g)完全燃烧生成氮气和气态水,放出133.5kJ热量。下列说法正确的是( )
A.该反应的热化学方程式为N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ·mol-1
B.N2H4的燃烧热534kJ·mol-1
C.相同条件下,1molN2H4(g)所含能量高于1molN2(g)和2molH2O(g)所含能量之和
D.该反应是放热反应,反应的发生不需要克服活化能
难度: 中等查看答案及解析
-
将V1mL 1.0 mol·L-1盐酸溶液和V2mL未知浓度的氢氧化钠溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
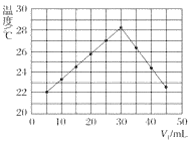
下列叙述正确的是( )
A.做该实验时环境温度为20 ℃
B.该实验表明化学能可能转化为热能
C.氢氧化钠溶液的浓度约为1.0 mol·L-1
D.该实验表明有水生成的反应都是放热反应
难度: 中等查看答案及解析
-
使用石油热裂解的副产物中的甲烷来制取氢气,需要分两步进行,其反应过程中的能量变化如图所示:
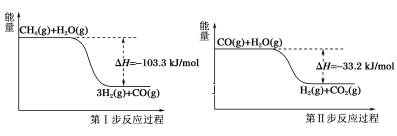
则甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为( )
A.CH4(g)+H2O(g)=3H2(g)+CO(g) ΔH=-103.3kJ/mol
B.CH4(g)+2H2O(g)=4H2(g)+CO2(g) ΔH=-70.1kJ/mol
C.CH4(g)+2H2O(g)=4H2(g)+CO2(g) ΔH=70.1kJ/mol
D.CH4(g)+2H2O(g)=4H2(g)+CO2(g) ΔH=-136.5kJ/mol
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说法中正确的是
A.上述四种元素的原子半径大小为W<X<Y<Z
B.W、X、Y、Z原子的核外最外层电子数的总和为20
C.W与Y可形成既含极性共价键又含非极性共价键的化合物
D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点
难度: 中等查看答案及解析
-
下列离子方程式错误的是
A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++ SO42-=BaS04↓+2H2O
B.酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+= 2Mn2++5O2↑+ 8H2O
C.等物质的量的MgCl2、Ba(OH)2和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓
D.铅酸蓄电池充电时的正极反应:PbSO4+ 2H2O-2e- = PbO2+4H++SO42-
难度: 中等查看答案及解析
-
W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。W、Z最外层电子数相同,Z的核电荷数是W的2倍。工业上一般通过电解氧化物的方法获得Y的单质,则下列说法不正确的是 ( )
A.W、X、Y形成的简单离子核外电子数相同
B.Z和W可形成原子个数比为1:2和1:3的共价化合物
C.Y和Z形成的化合物可以通过复分解反应制得
D.X、Y和Z三种元素形成的最高价氧化物对应的水化物能两两反应
难度: 中等查看答案及解析