-
创建美好生态环境是实现“中国梦”的重要一环。下列做法正确的是
A.Na2O能与SO2反应,用Na2O作工业废气脱硫剂
B.FeS作沉淀剂去除工业废水中的重金属离子
C.将“84”消毒液与洁厕灵混合使用增强去污效果
D.将废旧电池进行深埋防止废旧电池对环境的污染
难度: 简单查看答案及解析
-
下列各项叙述中,正确的是
A.AB3型的分子空间构型一定为平面三角形
B.电负性相差越大的元素间越易形成离子键
C.分子晶体中,分子间作用力越大,分子越稳定
D.用于幽门螺旋杆菌示踪的
价电子排布为2s22p3
难度: 中等查看答案及解析
-
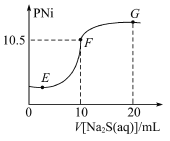
一定条件下,物质甲、乙之间存在转化关系
,则乙不可能是
A.CuS B.Fe(OH)3 C.FeCl2 D.NaHCO3
难度: 中等查看答案及解析
-
目前,科学家发现在负压和超低温条件下,可将水形成像棉花糖一样的气凝胶的冰,该冰称为“气态冰”。下列说法不正确的是
A.该冰具有丁达尔效应
B.“气态冰”与普通冰化学性质相同
C.18 g“气态冰”的在标况下体积等于22. 4 L
D.构成“气态冰"的分子为极性分子
难度: 中等查看答案及解析
-
类推法是学习化学的重要方法,由下列事实进行归纳推理,其中合理的是
选项
事实
推理
A
沸点:H2O高于H2S
沸点:H2S高于H2Se
B
NH4Cl溶液可用于处理铁锈
CH3COONH4溶液也可用于处理铁锈
C
常温下能用铝制或铁制容器贮运浓硫酸
常温下也能用铝制或铁制容器贮运浓硝酸
D
SO2通入BaCl2溶液中无沉淀
SO2通入Ba(NO3)2溶液中也无沉淀
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.pH =1的H2SO4溶液中SO42-的数目为0.5NA
B.1 mol金刚石中C-C数目为4NA
C.12.0 g NaHSO4晶体中阴阳离子数目为0.3NA
D.2.3 g Na与过量O2反应转移电子数目为0.1NA
难度: 中等查看答案及解析
-
用如下图所示的装置进行实验(夹持仪器略去),其中a、b、c中分别盛有试剂1、2、3,能达到实验目的的是
选项
试剂1
试剂2
试剂3
实验目的
装置
A
浓盐酸
MnO2
饱和NaCl溶液
制备纯净的Cl2
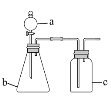
B
浓 HNO3
Cu片
KI--淀粉溶液
验证NO2的氧化性
C
稀硫酸
溶液X
澄淸石灰水
验证X中是否有CO32-
D
稀硫酸
FeS
酸性KMnO4溶液
验证H2S具有还原性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
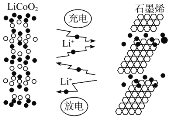
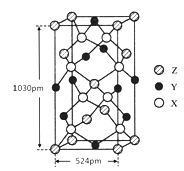
X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的两种元素组成的化合物,Z2为Z元素的一种单质。已知:A、D均含有10个电子,C的相对分子质量为30。上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中不正确的是
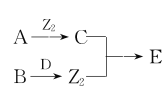
A.原子半径:W>Y>Z>X
B.若C中混有E可用水洗方法除去
C.A在工业上常用作制冷剂
D.B与D反应生成Z2时,D作还原剂
难度: 中等查看答案及解析
-
I-具有还原性,含碘食盐中的碘元素主要以KIO3的形式存在,I-、I2、IO3-在一定条件下可发生如图转化关系,下列说法不正确的是
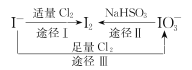
A.用淀粉-KI试纸和食醋可检验食盐是否加碘
B.由图可知氧化性的强弱顺序为Cl2>IO3->I2
C.生产等量的碘,途径I和途径II转移电子数目之比为5 :2
D.途径III反应的离子方程式:3Cl2+I-+3H2O=6Cl-+IO3-+6H+
难度: 中等查看答案及解析
-
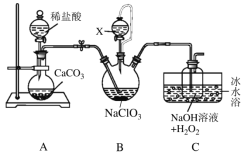
MnSO4•H2O是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰:下列说法错误的是
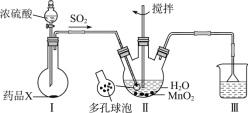
A.装置I烧瓶中放入的药品X为Na2SO3
B.装置II中用“多孔球泡”可增大SO2的吸收速率
C.装置Ⅲ烧杯中溶液为饱和NaHSO3
D.用装置II反应后的溶液制备MnSO4•H2O需经历蒸发浓缩、冷却结晶、过滤洗涤干燥等过程
难度: 中等查看答案及解析
-
《天工开物》记载:“凡火药以硝石、硫磺为主,草木灰为辅——而后火药成声”。其中涉及的主要反应为:S+2KNO3+3C=K2S+3CO2↑+N2↑。下列有说法不正确的是
A.硝石的主要成分是硝酸钾 B.第一电离能大小顺序:N>O>S>K
C.该反应属于自发反应 D.CO2和N2分子中均含有2个σ键
难度: 中等查看答案及解析
-
工业上常用电解对含氮生活污水进行处理。若污水中含有Cl-,主要靠有效氯(HC1O、ClO-)将NH4+氧化为N2。其工作原理如图所示,下列分析正确的是
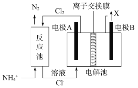
A.电极A为阴极
B.电极B上发生电极反应:2H++2e-=H2↑
C.电解池中离子交换膜为阴离子交换膜
D.处理含l mol NH4+的废水,反应池中共转移电子数目为3NA
难度: 中等查看答案及解析