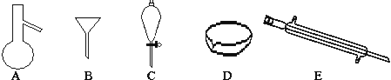-
大雾天气经常致使高速公路关闭,航班停飞。雾与下列分散系中属于同一类的是
A. 食盐水溶液 B. 碘的四氯化碳溶液 C. 泥水 D. 淀粉溶液
难度: 简单查看答案及解析
-
同温同压下,a g甲气体和2a g乙气体所占体积之比为1∶2,根据阿伏加德罗定律判断,下列叙述不正确的是
A.同温同压下甲和乙的密度之比为1∶1
B.甲与乙的相对分子质量之比为1∶1
C.同温同体积下等质量的甲和乙的压强之比为1∶1
D.等质量的甲和乙中的原子数之比一定为1∶1
难度: 困难查看答案及解析
-
下列物质与危险化学品标志的对应关系正确的是( )
A.
氯化钠 B.
乙醇
C.
木炭 D.
氢氧化钠
难度: 简单查看答案及解析
-
我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A. 萃取 B. 渗析 C. 蒸馏 D. 过滤
难度: 简单查看答案及解析
-
下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
纯净物
混合物
电解质
非电解质
A
盐酸
冰水混合物
硫酸
干冰
B
蒸馏水
蔗糖溶液
硫酸钡
二氧化硫
C
胆矾
盐酸
铁
乙醇
D
碘酒
食盐水
氯化铜
碳酸钙
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列变化中,必须加入氧化剂才能发生的是( )
A.SO2→S B.SO32-→SO2
C.I-→I2 D.HCO3-→CO32-
难度: 简单查看答案及解析
-
下列有关Fe(OH)3胶体的说法正确的是( )
A.取2 mol/L的FeCl3饱和溶液5 mL制成氢氧化铁胶体后,其中含有氢氧化铁胶粒数为0.01NA
B.在Fe(OH)3胶体中滴入稀硫酸至过量的过程中伴随的实验现象是先有红褐色沉淀产生,然后沉淀溶解得到棕黄色溶液
C.通过电泳实验可以证明Fe(OH)3胶体带正电荷
D.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,制备Fe(OH)3胶体
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
A.1.8 g的NH4+中含有的电子数为0.1NA
B.0.5 mol/L MgCl2溶液中含有Cl-的数目为NA
C.标准状况下,5.6 L H2O含有的电子数目为2.5 NA
D.13.2 g CO2和N2O形成的混合物含有的原子数目为0.9 NA
难度: 中等查看答案及解析
-
某小组同学配制480 mL 0.2 mol/L的NaCl溶液,下列说法正确的是( )
A.选用500 mL的容量瓶,且容量瓶无需干燥
B.用托盘天平准确称量5.85 g NaCl固体
C.定容时俯视容量瓶的刻度线,会使实验结果偏低
D.定容摇匀后发现液面低于刻度线,应再加蒸馏水至刻度线
难度: 简单查看答案及解析
-
已知Na2S2O3(S元素的化合价为+2价)可与氯气发生如下反应:4Cl2+Na2S2O3+5H2O=2NaCl+2H2SO4+6HCl,有关该反应的叙述错误的是( )
A.Cl2是氧化剂,H2SO4是氧化产物
B.还原性是S2O32-强于Cl-
C.水既不是氧化剂又不是还原剂
D.该反应消耗11.2 L Cl2时,转移的电子是1 mol
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.标准状况下,将22.4 LHCl溶于1 L水,可配成1 mol/L的稀盐酸
B.把200 mL3 mol/L的MgCl2溶液跟100 mL3 mol/L的KCl溶液混合后,溶液中的Cl-的物质的量浓度仍然是3 mol/L
C.用胆矾(CuSO4•5H2O)配制500 mL5 mol/L的CuSO4溶液,需胆矾40 g
D.将0.1 mol NaCl配成100 mL溶液,从中取出10 mL,所取出溶液的物质的量浓度为1 mol/L
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.失电子越多,还原性越强,得电子越多,氧化性越强
B.已知①Fe+Cu2+=Fe2++Cu;②2Fe3++Cu=2Fe2++Cu2+,则氧化性强弱顺序为Fe3+>Cu2+>Fe2+
C.已知还原性:B->C->D-,反应2C-+D2=2D-+C2和反应2C-+B2=2B-+C2都能发生
D.具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应
难度: 中等查看答案及解析
-
下列反应中,离子方程式书写正确的是( )
A.Fe和盐酸反应:Fe+2H+=Fe3++H2↑
B.硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.醋酸和碳酸钠溶液反应:2H++CO32-=H2O+CO2↑
D.石灰石和盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
难度: 中等查看答案及解析
-
某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,经测定Fe3+、SO42-、Al3+和M离子的物质的量之比为2:4:1:1,则M离子可能是下列中的( )
A.Na+ B.OH- C.Mg2+ D.Cl-
难度: 中等查看答案及解析
-
用等体积等物质的量浓度的BaCl2溶液可使相同体积的Fe2(SO4)3、FeSO4、K2SO4三种溶液中的SO42-离子恰好完全转化为沉淀,则三种溶液的物质的量浓度之比为( )
A.1:1:1 B.1:2:3 C.3:1:1 D.1:3:3
难度: 中等查看答案及解析
-
将氯气通入70℃的氢氧化钠水溶液中,能同时发生两个自身氧化还原反应(未配平):NaOH+Cl2→NaCl+NaClO+H2O,反应完成后测得溶液中NaClO与NaClO3的数目之比为5:2,则该溶液中NaCl与NaClO的数目之比为( )
A.3:1 B.2:1 C.15:2 D.1:1
难度: 中等查看答案及解析