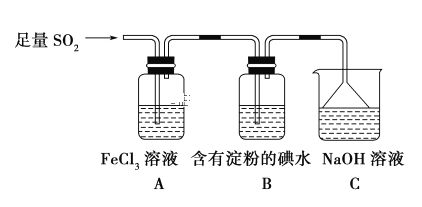
-
下列能量转化过程与氧化还原反应无关的是
A. 硅太阳能电池工作时,光能转化成电能
B. 锂离子电池放电时,化学能转化成电能
C. 电解质溶液导电时,电能转化成化学能
D. 葡萄糖为人类生命活动提供能量时,化学能转化成热能
难度: 中等查看答案及解析
-
下列化工生产过程中,未涉及氧化还原反应的是( )
A.海带提碘 B.氯碱工业
C.氨碱法制碱 D.海水提溴
难度: 中等查看答案及解析
-
化学与生活密切相关。下列说法错误的是
A.碳酸钠可用于去除餐具的油污 B.漂白粉可用于生活用水的消毒
C.氢氧化铝可用于中和过多胃酸 D.碳酸钡可用于胃肠X射线造影检查
难度: 简单查看答案及解析
-
《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是
A.蒸馏 B.升华 C.干馏 D.萃取
难度: 简单查看答案及解析
-
下列有关实验操作的叙述错误的是
A.过滤操作中,漏斗的尖端应接触烧杯内壁
B.从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁
C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
D.向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A. 0.1 mol·L−1KI 溶液:Na+、K+、ClO− 、OH−
B. 0.1 mol·L−1Fe2(SO4)3溶液:Cu2+、NH4+ 、NO3−、SO42−
C. 0.1 mol·L−1HCl 溶液:Ba2+、K+、CH3COO−、NO3−
D. 0.1 mol·L−1NaOH溶液:Mg2+、Na+、SO42−、HCO3−
难度: 中等查看答案及解析
-
下列有关从海带中提取碘的实验原理和装置能达到实验目的的是
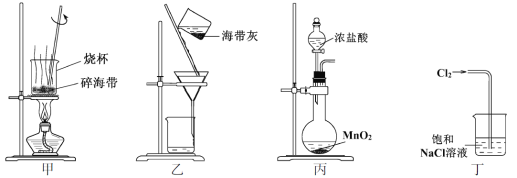
A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I−的Cl2
D. 用装置丁吸收氧化浸泡液中I−后的Cl2尾气
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.质量数为31的磷原子:
B.氟原子的结构示意图:
C.CaCl2的电子式:
D.明矾的化学式:Al2(SO4)3
难度: 简单查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
向苯酚浊液中滴加Na2CO3溶液,浊液变清
苯酚的酸性强于H2CO3的酸性
B
向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
C
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+的氧化性强于Cu2+的氧化性
D
向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成
Ksp(AgCl) >Ksp(AgI)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.钠与水反应:Na +2H2O=Na++2OH–+H2↑
B.电解饱和食盐水获取烧碱和氯气:2Cl–+2H2O
H2↑+Cl2↑+2OH–
C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH–+H++SO42-=BaSO4↓+H2O
D.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH–=CaCO3↓+H2O
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A. Fe
FeCl2
Fe(OH)2 B. S
SO3
H2SO4
C. CaCO3
CaO
CaSiO3 D. NH3
NO
HNO3
难度: 中等查看答案及解析
-
锂和钾两种元素相比较,正确的是
A.锂的还原性比钾的弱 B.锂原子的半径比钾的大
C.锂的金属性比钾的强 D.锂单质的熔点比钾的低
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.用坩埚钳夹住一小块经砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来
B.Al、盐酸、NaOH溶液三者之间两两均能发生反应
C.铝与Fe2O3发生铝热反应后固体物质增重
D.常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完
难度: 中等查看答案及解析
-
阿伏加德罗常数的值为
。下列说法正确的是
A. 1L0.1mol·
NH4Cl溶液中,
的数量为0.1
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2
难度: 困难查看答案及解析