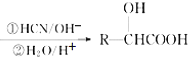-
关于新型冠状病毒,下来说法错误的是
A.该病毒主要通过飞沫和接触传播 B.为减少传染性,出门应戴好口罩
C.该病毒属于双链的DNA病毒,不易变异 D.该病毒可用“84消毒液”进行消毒
难度: 简单查看答案及解析
-
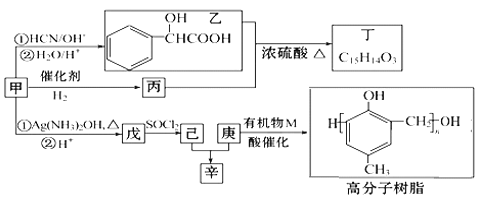
实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是
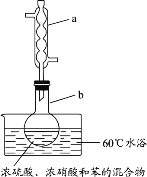
A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.浓硫酸、浓硝酸和苯混合时,应先向浓硝酸中缓缓加入浓硫酸,待冷却至室温后,再将苯逐滴滴入
C.仪器a的作用是冷凝回流,提高原料的利用率
D.反应完全后,可用仪器a、b蒸馏得到产品
难度: 中等查看答案及解析
-
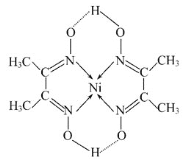
萜类化合物广泛存在于动植物体内,某萜类化合物如下图所示,下列说法正确的是
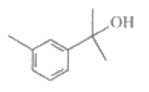
A.此萜类化合物的化学式为C10H14O
B.该有机物属于芳香烃
C.分子中所有碳原子均处于同一平面上
D.在浓硫酸、加热条件下,可生成两种芳香烯烃
难度: 中等查看答案及解析
-
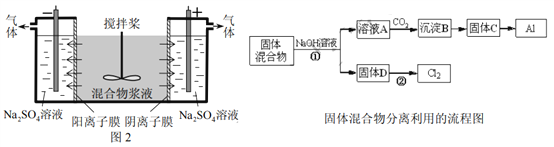
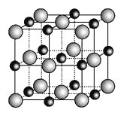
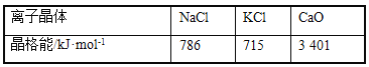
W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。W、Z最外层电子数相同,Z的核电荷数是W的2倍。工业上一般通过电解氧化物的方法获得Y的单质,则下列说法不正确的是
A.W、X、Y形成的简单离子核外电子数相同
B.Y和Z形成的化合物可以通过复分解反应制得
C.Z和W可形成原子个数比为1∶2和1∶3的共价化合物
D.X、Y和Z三种元素形成的最高价氧化物对应的水化物能两两反应
难度: 简单查看答案及解析
-
热催化合成氨面临的两难问题是:采用高温增大反应速率的同时会因平衡限制导致NH3产率降低。我国科研人员研制了Ti-H-Fe双温区催化剂(Ti-H区域和Fe区域的温度差可超过100℃)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是
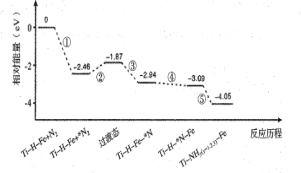
A.①为N
N的断裂过程
B.① ③在高温区发生,②④⑤在低温区发生
C.④为N原子由Fe区域向Ti-H区域的传递过程
D.使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
难度: 中等查看答案及解析
-
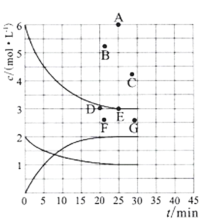
pC类似pH,如图为CO2的水溶液中加入强酸或强碱溶液后,平衡时溶液中各种组分的pC - pH图。依据图中信息,下列说法不正确的是
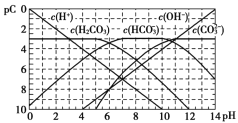
A.
不能在同一溶液中大量共存
B.H2CO3电离平衡常数
C.人体血液里主要通过碳酸氢盐缓冲体系(
)可以抵消少量酸或碱,维持pH =7.4,但当过量的酸进入血液中时,血液缓冲体系中的
最终将变大
D.pH =9时,溶液中存在关系
难度: 中等查看答案及解析
-
如图所示是一种以液态肼(N2H4)为燃料氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时,O2—可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
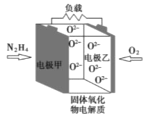
A.电池内的O2—由电极甲移向电极乙
B.电池总反应为N2H4+2O2=2NO+2H2O
C.当甲电极上有1molN2H4消耗时,标况下乙电极上有22.4LO2参与反应
D.电池外电路的电子由电极乙移向电极甲
难度: 中等查看答案及解析