-
化学与生产、生活息息相关。下列有关说法不正确的是
A.小苏打可用于治疗胃酸过多
B.还原铁粉可用作食品袋内的抗氧化剂
C.用乙醚从青蒿中提取青蒿素的过程中包含萃取操作
D.墨子号量子卫星使用的太阳能电池,其主要成分为二氧化硅
难度: 简单查看答案及解析
-
下列关于有机物的说法不正确的是
A.正丁烷和异丁烷的沸点相同
B.麦芽糖的水解产物只有葡萄糖
C.疫苗冷藏存放的目的是避免蛋白质变性
D.苯与乙烯均可以使溴水褪色,但褪色原理不同
难度: 简单查看答案及解析
-
W、X、Y、Z、R是原子序数依次增大的五种短周期元素,其中W、R同主族;X是形成化合物种类最多的元素;常温下,W与Z能形成两种常见的液态化合物。下列说法正确的是
A.X、Y的简单氢化物的沸点:X>Y
B.Z、R的简单离子的半径大小:Z<R
C.Y与W形成的最简单化合物可用作制冷剂
D.1mol R2Z2与足量W2Z反应,转移的电子数为2NA
难度: 中等查看答案及解析
-
为探究新制氯水的性质,某学生做了如下实验。
实验
装置
试剂a
现象
①

紫色的石蕊试液
溶液先变红后褪色
②
NaHCO3溶液
产生气泡
③
HNO3酸化的AgNO3溶液
产生白色沉淀
④
FeCl2溶液、KSCN溶液
溶液变红
由上述实验可得新制氯水的性质与对应的解释或离子方程式不相符的是
A.实验①说明新制氯水中含有H+、HClO
B.实验②发生的反应为HCO3-+HClO=ClO-+CO2↑+H2O
C.实验③说明新制氯水中有Cl-,Cl-+Ag+=AgCl↓
D.实验④说明氯气具有强氧化性,Cl2+2Fe2+=2Cl-+2Fe3+
难度: 中等查看答案及解析
-
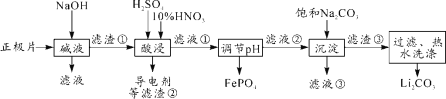
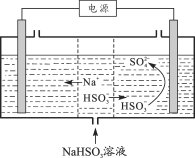
我国某科研机构研究表明,利用K2Cr2O7可实现含苯酚废水的有效处理,其工作原理如下图所示。下列说法正确的是
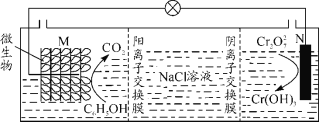
A.N为该电池的负极
B.该电池可以在高温下使用
C.一段时间后,中间室中NaCl溶液的浓度减小
D.M的电极反应式为:C6H5OH+28e-+11H2O=6CO2↑+28H+
难度: 中等查看答案及解析
-
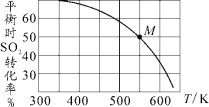
自然界中时刻存在着氮的转化。实现氮按照一定方向转化一直是科学领域研究的重要课题,如图为N2分子在催化剂的作用下发生的一系列转化示意图:
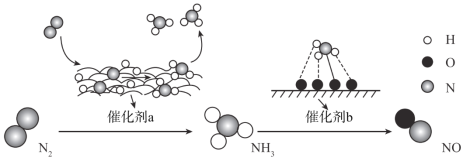
下列叙述正确的是
A.N2
NH3,NH3
NO均属于氮的固定
B.催化剂a作用下氮原子发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.使用催化剂a、b均可以提高单位时间内生成物的产量
难度: 中等查看答案及解析
-
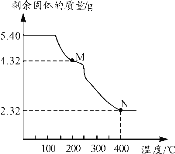
常温下,向1L0.01mol·L-1一元酸HR溶液中逐渐通入氨气[常温下NH3·H2O电离平衡常数K=1.76×10-5],保持温度和溶液体积不变,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述不正确的是
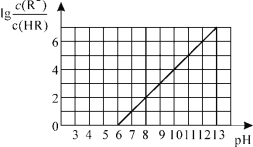
A.0.01mol·L-1HR溶液的pH约为4
B.随着氨气的通入,
逐渐减小
C.当溶液为碱性时,c(R-)>c(HR)
D.当通入0.01 mol NH3时,溶液中存在:c(R-)>c(NH4+)>c(H+)>c(OH-)
难度: 困难查看答案及解析