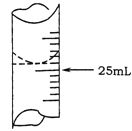
-
标准状况下,将2.24LNH3通入1L 0.1mol/L的乙酸溶液中,欲确定所得溶液中NH4+、CH3COO-、H+和OH-浓度大小顺序,通过下列数据即可得出正确结论的是
①NH3·H2O和CH3COOH的电离常数 ②NH3·H2O和CH3COONH4的电离常数 ③溶液的pH
A. 不需任何数据
B. 必需知道①、②、③三组数据
C. 只需知道①、③中的任一组数据
D. 只需知道①、②、③中的任一组数据
难度: 中等查看答案及解析
-
汽水是CO2的饱和溶液,其中存在如下平衡:
H2CO3
H++HCO3-……① HCO3-
H++CO32-……②
将汽水倒入试管中分别进行下列实验,相应分析结论错误的是
A.加热、平衡①、②可能都向左移动
B.加入澄清石灰水,平衡①、②均向右移动
C.加入CaCO3悬浊液,CaCO3的溶解平衡向正方向移动
D.通入过量CO2或滴加氯水,溶液pH均减小
难度: 中等查看答案及解析
-
氢氰酸(HCN)的下列性质中,不能证明它是弱电解质的是
A. 1 mol/L氢氰酸溶液的pH约为3
B. 常温下,pH=a的HCN稀释100倍后所得溶液pH<(a +2)[(a +2)<7]
C. 10 mL 1 mol/L HCN恰好与10 mL 1 mol/L NaOH溶液完全反应
D. NaCN溶液呈碱性
难度: 中等查看答案及解析
-
下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②③ B. ②③④
C. ①④⑤ D. ①②③④⑤
难度: 简单查看答案及解析
-
酸碱完全中和时
A. 酸和碱的物质的量一定相等
B. 酸所提供的H+与碱提供的OH-的物质的量相等
C. 酸和碱的物质的量浓度相等
D. 溶液一定呈中性
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是( )
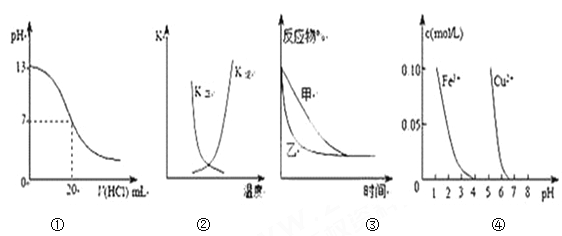
A. 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2A(g) + B(g)
2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化
C. 图③表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,乙压强比甲压强大
D. 据图④若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右。
难度: 中等查看答案及解析
-
下列有关实验的原理、方法和结论都正确的是
A.将等体积、等pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH变化大
B.用CH3COOH溶液作导电性实验,灯光较暗,说明CH3COOH是弱电解质
C.向滴有酚酞的Na2CO3溶液中逐滴加入Ba(NO3)2,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡
D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
难度: 中等查看答案及解析
-
下述实验能达到顶期目的的是
编号
实验内容
实验目的
A
向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀
证明在相同条件下,溶解度Mg(OH)2>Fe(OH)3
B
向混有BaCO3沉淀的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂)
滴定其中NaOH含量
C
两种一元碱溶液X和Y(X的pH比Y大l),分别加水稀释l00倍后,pH相等
证明稀释前c(X)=10c(Y)
D
测定等物质的量浓度的HF与HCl溶液的pH,后者较小
证明非金属性Cl>F
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列关于各图的叙述中正确的是

A. 图甲表示l mol H2(g)完全燃烧生成水蒸气吸收241.8 kJ热量
B. 图甲表示2 mol H2(g)所具有的能量比2 mol H2O(g)所具有的能量多483.6 kJ
C. 图乙表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同温、同浓度的NaA溶液的pH小于NaB溶液的pH
D. 图乙中起始时HA的物质的量浓度大于HB
难度: 中等查看答案及解析
-
人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:
H++HCO3-
H2CO3
CO2+H2O
H++PO43-
HPO42-
H++HPO42-
H2PO4-
故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人在静脉滴注的大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH值显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH值略减小
难度: 中等查看答案及解析
-
在下列有FeCl3溶液参加的反应中,与Fe3+水解有关的反应是
①FeCl3溶液与Cu的反应 ②将FeCl3溶液加热蒸干,并灼烧最终得到Fe2O3 ③饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体 ④配制FeCl3溶液需加入一定量的盐酸
A.①④ B. ②③④ C.②③ D. ①②③④
难度: 中等查看答案及解析
-
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH=1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低。
②pH=2的盐酸和pH=1的醋酸,c(H+)之比为2∶1。
③在Na2CO3和NaHCO3溶液中均存在下列关系c(Na+)+c(H+)=c(OH-)+c(HCO3‑)+2c(CO32-)
④反应2A (s) + B (g)=2C (g) + D (g) 不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;
则三者关系为:Ka·Kh=Kw
⑥反应A(g)
2B(g);△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则△H =(Ea -Eb)kJ·mol-1。其归纳正确的是
A.①②③⑥ B.③④⑤⑥ C.②④⑤⑥ D.①③④⑤
难度: 困难查看答案及解析
-
25℃时,0.01 mol·L-1两种弱酸溶液的pH如表,下列说法正确的是

A.相同pH的两种酸溶液中,CH3COOH溶液中水电离的c(H+)较大
B.物质的量浓度相同的CH3COONa与NaCN 溶液中,CH3COONa溶液pH较大
C.等体积pH相同的两种酸溶液,分别滴加NaOH溶液至恰好中和,消耗等量的NaOH
D.HCN的电离平衡常数(Ka)与CN—的水解平衡常数(K)存在如下关系:Ka•K=Kw
难度: 困难查看答案及解析
-
下列图示与对应的叙述相符的是

A. 图Ⅰ表示盐酸滴加到0.1 mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂
B. 图Ⅱ表示一定条件下进行的反应2SO2+O2
2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积
C. 图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2 溶液时铝离子恰好沉淀完全
D. 图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸
难度: 中等查看答案及解析
-
在密闭容器中进行反应:2A(g)+B(g)
3C(g)+Q(Q>0)。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是

A.图I表示温度对化学平衡的影响,且甲的温度较高
B.图Ⅱ表示t0时刻缩小容器体积对反应速率的影响
C.图Ⅲ表示t0时刻增大B浓度对反应速率的影响
D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
难度: 困难查看答案及解析
-
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25 ℃时:
①HF(aq)+OH-(aq)===F-(aq)+H2O(l)
H=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)===H2O(l)
H=-57.3 kJ·mol-1
在20 mL 0.1 mol·L-1氢氟酸中加入V mL 0.1 mol·L-1 NaOH溶液,下列有关说法正确的是( )
A.氢氟酸的电离方程式及热效应可表示为:HF(aq)
F-(aq)+H+(aq)
H=+10.4 kJ·mol-1
B.当V=20时,溶液中:c(OH-)=c(HF)+c(H+)
C.当V=20时,溶液中:c(F-)<c(Na+)=0.1 mol·L-1
D.当V>0时,溶液中一定存在:c(Na+)>c(F-)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是
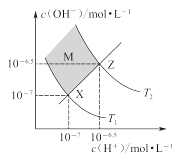
A. 两条曲线间任意点均有c(H+)·c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
难度: 简单查看答案及解析
-
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)
Z(g)+W(s);△H>0下列叙述正确的是( )
A. 加入少量W,逆反应速率增大 B. 当容器中气体密度不变时,反应达到平衡
C. 升高温度,平衡逆向移动 D. 平衡后加入X,上述反应的△H增大
难度: 简单查看答案及解析



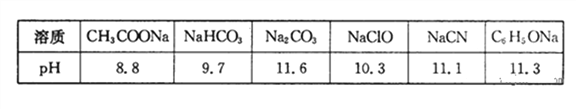
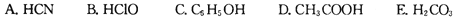
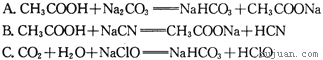

 ,又知常温下某CuSO4溶液里c(Cu2+)=0.02mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于______.
,又知常温下某CuSO4溶液里c(Cu2+)=0.02mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于______. 是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表: ①写出该反应平衡常数的表达式:______
①写出该反应平衡常数的表达式:______