-
下列说法中,错误的是( )
A. 人类目前所直接利用的能量大部分是由化学反应产生的
B. 煤、石油、天然气是当今世界最重要的三种化工燃料
C. 人体运动所消耗的能量与化学反应无关
D. 我国目前最主要的能源是煤炭
难度: 简单查看答案及解析
-
下列反应中属于吸热反应的是
A.铝与盐酸反应 B.酸碱中和反应
C.硫在空气或氧气中燃烧 D.Ba(OH)2·8H2O与NH4Cl反应
难度: 简单查看答案及解析
-
在2A(g)+B(g)
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1
难度: 简单查看答案及解析
-
反应:A(气)+3B(气)
2C(气); ΔH<0达平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
A.正反应速率加大,逆反应速率变小
B.正反应速率变小,逆反应速率加大
C.正反应速率和逆反应速率都变小
D.正反应速率和逆反应速率都变大
难度: 中等查看答案及解析
-
下列防止金属腐蚀的做法不可行的是( )
A.在某些工具的机械转动部位刷油漆以防锈
B.衣架和电线外面包上一层塑料层以防锈
C.在钢材制造的大型船舶上装上一定数量的锌块
D.自行车的钢圈和车铃上镀上一层铬,既耐腐蚀又美观耐磨
难度: 简单查看答案及解析
-
固定容积为2 L的密闭容器中发生反应xA(g)+yB(g)
zC(g),图1表示T ℃时容器中各物质的量随时间变化的关系,图2表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
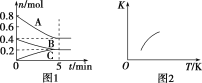
A.该反应可表示为2A(g)+B(g)
C(g) ΔH<0
B.T ℃时该反应的平衡常数K=6.25
C.当容器中气体密度不再变化时,该反应达到平衡状态
D.T ℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25
难度: 中等查看答案及解析
-
用标准盐酸滴定氢氧化钠溶液(甲基橙作指示剂),下列操作正确的是
A.锥形瓶用蒸馏水洗涤后,再用氢氧化钠溶液润洗
B.滴定管用蒸馏水洗涤后,即装入标准盐酸进行滴定
C.当滴定至溶液由黄色变为橙色时,即为滴定终点
D.滴定时,边摇动锥形瓶边观察瓶中溶液的颜色变化
难度: 简单查看答案及解析
-
盐类水解在工农业生产和日常生活中有着广泛的应用,有关应用或说法与盐类水解无关的是
A.用热的纯碱溶液洗涤餐具上的油污
B.生活中常用明矾净水
C.用稀硫酸或浓氨水除去铜器表面的铜绿
D.长期使用硫酸铵化肥的土壤,易变酸性,可施用适量的熟石灰
难度: 简单查看答案及解析
-
将氨水滴加到盛有AgCl的试管中直至AgCl完全溶解,对上述过程的有关解释或叙述正确的是
A.所得溶液中c(Ag+ )· c(Cl-)>Ksp(AgCl)
B.上述实验说明Cl-与NH4+间有很强的结合力
C.所得溶液中形成了难电离的物质
D.上述过程中NH3·H2O的电离常数增大
难度: 简单查看答案及解析
-
析氢腐蚀和吸氧腐蚀的负极反应是( )
A.Fe-2e-=Fe2+ B.2H+ +2e-=H2↑ C.O2+4e- +2H2O= 4OH- D.Fe-3e-=Fe3+
难度: 简单查看答案及解析
-
下图为铜—锌—稀硫酸原电池示意图,下列说法正确的是 ( )
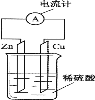
A.电子由铜片通过导线流向锌片
B.锌得电子,被还原
C.锌为负极,铜为正极
D.该装置能将电能转变为化学能
难度: 简单查看答案及解析
-
下列化学电池不易造成环境污染的是
A.氢氧燃料电池 B.锌锰电池
C.镍镉电池 D.铅蓄电池
难度: 简单查看答案及解析
-
下列金属使用电解法冶炼获得的是
A.铝 B.锌 C.铜 D.金
难度: 简单查看答案及解析
-
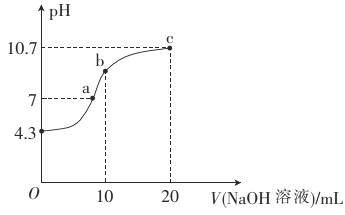
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法中正确的是( )
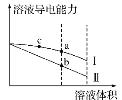
A.两溶液稀释前的浓度相同
B.a、b、c三点溶液的pH由大到小顺序为a>b>c
C.a点的Kw值比b点的Kw值大
D.a点水电离的c(H+)大于c点水电离的c(H+)
难度: 中等查看答案及解析
-
反应A→C的过程中能量的变化如图所示,那么这个反应的活化能是
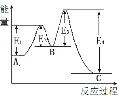
A.E1 +E3-E4 B.E1+E3-E2 C.E1+E2+E3 D.E1 +E3-E2-E4
难度: 中等查看答案及解析
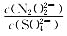 =______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]