-
下列说法错误的是( )
A. 熟的鸡蛋不能孵化成小鸡的原因是蛋白质变性
B. 天然气和液化石油气是我国目前推广使用的清洁燃料
C. “地沟油”不能食用但可以用来制肥皂
D. 麦芽汁(含麦芽糖)在酵母菌的作用下发酵,能得到不含酒精的鲜啤酒
难度: 中等查看答案及解析
-
下列实验操作中,装置选择不合理的是( )
A
B
C
D
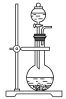
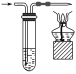


快速制备少量NH3
H2的尾气处理
测量NO的体积
除去乙烯中的SO2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
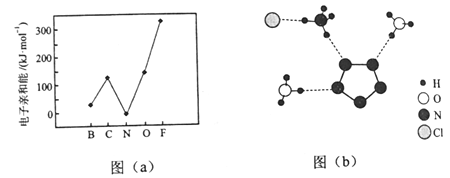
甲、乙、丙、丁是原子序数依次增大的四种短周期元素,A、B、C、D、E是由其中的两种或三种元素组成的化合物,F是由丙元素形成的单质。已知:A+B→D+F、A+C→E+F(均未配平);0.1mol·L-1D溶液的pH=13(25℃)。下列说法正确的是( )
A.原子半径:丁>丙>乙>甲
B.1molA与足量B完全反应共转移了2mol电子
C.丙元素在周期表中的位置为第二周期第ⅣA族
D.由甲、乙、丙、丁四种短周期元素组成的盐,其水溶液既有呈酸性的,也有呈碱性的
难度: 中等查看答案及解析
-
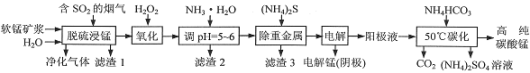
增塑剂DCHP可由环己醇制得。DCHP和环己醇的结构简式如图所示,下列说法错误的是( )
环己醇

DCHP
A. DCHP的分子式为C20H26O4
B. 环己醇分子中所有碳原子不可能共平面
C. DCHP的一氯取代物有5种
D. DCHP通过取代反应可以得到环己醇
难度: 中等查看答案及解析
-
法国格勒诺布尔(Grenoble)约瑟夫·傅立叶大学的研究小组发明了第一块可植入人体为人造器官提供电能的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶的作用下发生反应:C6H12O6+6O2
6CO2+6H2O(酸性环境)。下列有关该电池的说法不正确的是( )
A. 该生物燃料电池不可以在高温下工作
B. 电池的负极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+
C. 消耗1 mol氧气时转移4 mol e-,H+向负极移动
D. 今后的研究方向是设法提高葡萄糖生物燃料电池的效率,从而使其在将来可以为任何可植入医疗设备提供电能
难度: 中等查看答案及解析
-
用0.1 mol·L−1的盐酸滴定20 mL约0.1 mol·L−1氨水,滴定曲线如图所示,下列说法正确的是
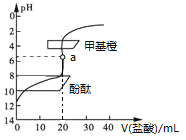
A. a点溶液中:c(H+)=c(OH−)+c(NH3·H2O)
B. 滴定过程中,当溶液的pH=7时,两者恰好中和
C. 用酚酞作指示剂比用甲基橙作指示剂,滴定误差更小
D. 当滴入盐酸为30 mL时,溶液中:c(NH4+)+c(H+)<c(OH−)+c(Cl−)
难度: 困难查看答案及解析