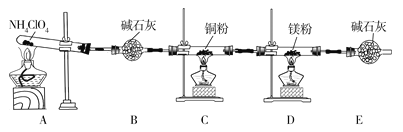
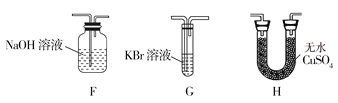
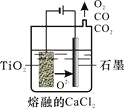
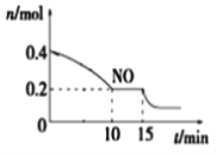
-
食品保鲜所用的“双吸剂”,是由还原铁粉、生石灰、氯化钠、炭粉等按一定比例组成的混合物,可吸收氧气和水。下列分析不正确的是( )
A.“双吸剂”中的生石灰有吸水作用
B.“双吸剂”吸收氧气时,发生了原电池反应
C.吸收氧气的过程中,铁作原电池的负极
D.炭粉上发生的反应为:O2+4e﹣+4H+=2H2O
难度: 中等查看答案及解析
-
化学与科技、社会、生活有着密切的联系,下列有关说法正确的是( )
A.可吸入颗粒物中含有的铅、镉、铬、钒、砷等对人体有害的元素均为金属元素
B.乙醇和汽油都是可再生能源,应大力推广乙醇汽油的使用
C.单质硅晶体是将太阳能转化为电能的常用材料
D.新型能源生物柴油和矿物油的主要化学成分相同
难度: 中等查看答案及解析
-
下列说法正确的是
A.C2H6O和C4H10都有2种同分异构体
B.在一定条件下,乙烯能与H2发生加成反应,苯不能与H2发生加成反应
C.乙酸乙酯、乙酸均能与NaOH反应,二者分子中官能团相同
D.淀粉和蛋白质均可水解生成葡萄糖
难度: 中等查看答案及解析
-
下列有关说法中不正确的是
A.将SO2通入BaCl2溶液中至饱和,无沉淀产生,再通入过量NH3,产生沉淀
B.高纯硅常用作光导纤维的原料
C.用AlCl3溶液制取Al(OH)3,沉淀剂选用氨水比选用NaOH溶液好
D.纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,反应速率加快
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是( )
A.AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+2H2O+4NH4+
B.硫化钠的水解反应:S2-+2H2O
H2S+2OH-
C.将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合HCO3-+Ba2++OH-=BaCO3↓+H2O
D.单质铜与稀硝酸反应:Cu+2H++2NO3-=Cu2++2NO↑+H2O
难度: 中等查看答案及解析
-
下列实验装置设计与对应结论正确的是( )
选项
A
B
C
D
装置
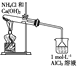

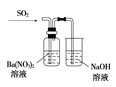
结论
能证明Al(OH)3不溶于氨水
能证明非金属性:Cl>C>Si
验证铁发生析氢腐蚀
洗气瓶中产生的白色沉淀是BaSO3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
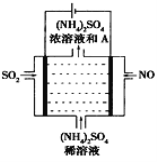
海冰是海水冻结而成的咸水冰。海水冻结时,部分来不及流走的盐分以卤汁的形式被包围在冰晶之间,形成“盐泡”
假设盐分以一个NaCl计
,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )
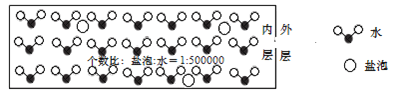
A.海冰内层“盐泡”越多,密度越小
B.海冰冰龄越长,内层的“盐泡”越多
C.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
D.海冰内层NaCl的浓度约为
设冰的密度为
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=7的溶液中:Al3+、Cl-、SO42-、CO32-
B.由水电离出来的c(H+)=10-12mol/L的溶液中:Na+、HCO3-、SO42-、K+
C.pH=0的溶液中:Na+、K+、Fe2+、NO3-
D.使酚酞试液变红的溶液中:AlO2-、SO42-、SO32-、Na+
难度: 简单查看答案及解析
-
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)
Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol·L-1,则H2反应速率为0.03mol·L-1·min-1
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH溶液恰好反应
难度: 简单查看答案及解析
-
下列鉴别实验中,所选试剂不合理的是( )
A.用水鉴别乙醇和苯
B.用碳酸氢钠溶液鉴别乙酸和乙醇
C.用新制的氢氧化铜鉴别葡萄糖和蔗糖
D.用高锰酸钾酸性溶液鉴别甲苯和己烯
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24L苯中含C-H数目为0.6 NA
B.常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA
C.常温下,1.0LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
D.在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3molCl2转移的电子数为6NA
难度: 中等查看答案及解析
-
实验法和比较法是研究物质性质的基本方法。以下实验设计中,不合理或不严密的是
A.钠和镁分别与冷水反应,判断钠和镁金属性强弱
B.测定相同温度下盐酸和醋酸溶液的pH,就可证明盐酸是强酸、醋酸是弱酸
C.铁分别与氯气和硫反应,判断氯气与硫的氧化性强弱
D.测定相同条件下Na2CO3溶液和Na2SO4溶液的pH,判断碳与硫的非金属性强弱
难度: 中等查看答案及解析
-
下列判断中,正确的是( )
A.已知25 ℃时NH4CN显碱性,则25 ℃时的电离常数K(NH3·H2O)>K(HCN)
B.25 ℃时,Mg(OH)2固体在20 mL0.01 mol·L-1氨水中的Ksp比在20 mL0.01 mol·L-1 NH4Cl溶液中的Ksp小
C.pH试纸测得新制氯水的pH为4
D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干.灼烧都得到Fe2O3
难度: 中等查看答案及解析
-
X、Y、Z、W四种短周期元素在周期表中相对位置如下表所示,Y是地壳中含量最高的元素。下列说法中不正确的是( )
X
Y
Z
W
A.Z的原子半径大于Y
B.Y的非金属性强于W
C.W的氧化物对应的水化物都是强酸
D.X、Z的最高价氧化物均可与NaOH溶液反应
难度: 中等查看答案及解析
-
某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是
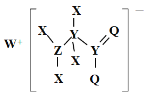
A.Z的最高价氧化物对应的水化物是一元强酸
B.WX的水溶液呈中性
C.元素非金属性的顺序为Y>Z>Q
D.该化合物中与Y单键相连的Q不满足8电子稳定结构
难度: 中等查看答案及解析
-
有一种新型燃料电池,工作时在一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。现用该燃料电池和惰性电极电解Na2SO4溶液一段时间,假设电解时温度不变,下列说法不正确的是( )
A.在熔融电解质中,O2-由正极移向负极
B.通入空气的一极是正极,电极反应式为O2+4e-=2O2-
C.电解池的阳极反应式为2H2O-4e-=4H++O2↑
D.电解一共生成0.9mol气体时,理论上消耗0.1mol丁烷
难度: 中等查看答案及解析