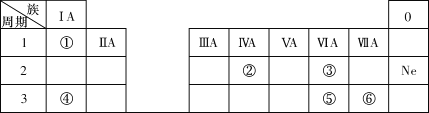
-
下列行为中,符合安全要求的是
A. 节日期间,在任意场所燃放烟花爆竹
B. 实验时,将水倒入浓硫酸配置稀硫酸
C. 煤矿矿井,必须通风,严禁烟火
D. 用点燃的火柴在液化气钢瓶口检验是否漏气
难度: 简单查看答案及解析
-
环境污染危害人体健康,下列做法会造成大气污染的是
A.使用太阳能热水器 B.使用电动公交车
C.大量焚烧秸秆 D.用天然气代替煤作燃料
难度: 简单查看答案及解析
-
用红色激光照射下列物质,能观察到丁达尔效应的是
A.乙醇溶液 B.氢氧化铁胶体 C.硫酸铜溶液 D.蔗糖溶液
难度: 简单查看答案及解析
-
下列化学反应中,属于吸热反应的是
A. 木炭燃烧反应 B. 稀硫酸与烧碱反应
C. 生石灰与水反应 D. Ba(OH)2·8H2O与NH4Cl晶体
难度: 简单查看答案及解析
-
下列离子在含有0.1mol/LSO42- 的溶液中不能大量共存的是
A.Al3+ B.Cu2+ C.Fe3+ D.Ba2+
难度: 简单查看答案及解析
-
下列试剂常用来检验Fe3+的是
A.氯水 B.BaCl2溶液 C.KSCN溶液 D.KNO3溶液
难度: 简单查看答案及解析
-
下列气体溶于水,所得溶液呈碱性的是
A.NH3 B.NO2 C.SO2 D.SO3
难度: 简单查看答案及解析
-
在反应2 H2O2=2H2O +O2中,下列操作能减小反应速率的是
A.降低温度 B.升高温度 C.增大H2O2的浓度 D.加入少量MnO2
难度: 简单查看答案及解析
-
下列物质不与氢氧化钠溶液反应的是
A.Al B.Al2O3 C.Al(OH)3 D.NaAlO2
难度: 简单查看答案及解析
-
下列物质不能使有色布条褪色的是
A.次氯酸溶液 B.次氯酸钠溶液 C.漂白粉溶液 D.氯化钙溶液
难度: 简单查看答案及解析
-
下列离子方程式中,正确的是
A.稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B.铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+
C.盐酸与氢氧化钡溶液反应:H++OH-=H2O
D.碳酸钙和稀盐酸反应:CO32-+2H+=CO2↑+H2O
难度: 中等查看答案及解析
-
对于1mol/L的NaOH溶液,下列有关说法正确的是
A.Na+的数目为NA B.OH-的物质的量为1mol
C.Na+的物质的量浓度为1mol/L D.NaOH的质量为40g
难度: 简单查看答案及解析
-
碳酸钠(Na2CO3)俗名苏打,属于
A.酸 B.碱 C.盐 D.氧化物
难度: 简单查看答案及解析
-
氧元素有多种核素,其中核素
O的中子数是
A.8 B.10 C.18 D.26
难度: 简单查看答案及解析
-
下列物质中,能作为潜水员和宇航员的供氧剂的是
A.水玻璃 B.氢氟酸 C.过氧化钠 D.高锰酸钾
难度: 简单查看答案及解析
-
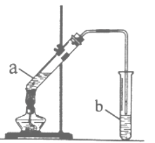
从不含杂质的氯化钠溶液中获得氯化钠晶体,采用的操作是
A.
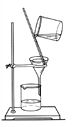 B.
B.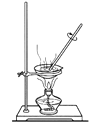 C.
C.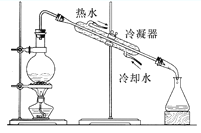 D.
D.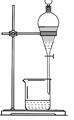
难度: 中等查看答案及解析
-
海水是重要的水资源。下列方法可用于淡化海水的是
A.蒸馏法 B.过滤法 C.分液法 D.萃取法
难度: 简单查看答案及解析
-
高炉炼铁的主要反应是:Fe2O3+3CO=2Fe+3CO2,该方法在治金工业上称为
A.电解法 B.热还原法 C.热分解法 D.铝热法
难度: 中等查看答案及解析
-
某化学课外活动小组组装了右图所示的西红柿电池,下列有关该电池的说法正确的是
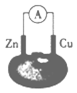
A.铜作负极 B.锌作正极
C.电子由铜经导线流向锌 D.锌片上的反应为:Zn – 2e- =Zn2+
难度: 简单查看答案及解析
-
下列反应中,属于加成反应的是
A.CH4+C12
CH3Cl+HCl
B.CH2= CH2+ C12
C.
+Br2
+HBr
D.CH4+2O2
CO2+2H2O
难度: 中等查看答案及解析
-
滥用药物有碍健康,下列有关用药的叙述正确的是
A.长期大量服用阿司匹林可预防感冒
B.运动员长期服用麻黄碱可提高成绩
C.服用氢氧化钠溶液可中和过多的胃酸
D.注射青霉素前要先做皮肤敏感试验
难度: 简单查看答案及解析
-
利用铝热反应原理可以制取金属锰, 化学方程式为3MnO2+4Al
3Mn+2Al2O3,该反应的氧化剂是
A. MnO2 B. Al C. Mn D. Al2O3
难度: 简单查看答案及解析
-
已知该反应4NH3+5O2=4NO+6H2O中,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是
A.
v(NH3)=v(O2) B.
v(O2)=v(H2O)
C.
v(NH3)=v(H2O) D.
v(O2)=v(NO)
难度: 简单查看答案及解析
-
已知可逆反应N2(g)+3H2(g)
2NH3(g)达到平衡时,其平衡常数表达式正确的是
A.K=c(N2)▪c(H2)/c(NH3) B.K=c(N2)▪c3(H2)/c(NH3)
C.K=c2(NH3)/c(N2)▪c3(H2) D.K=c(NH3)/c(N2)▪c3(H2)
难度: 中等查看答案及解析