-
亚硝酸钠(NaNO2)具有致癌作用,许多腌制食品中含NaNO2。酸性KMnO4溶液与亚硝酸钠反应的离子反应为:MnO4- +NO2- +H+ → Mn2++NO3- +H2O(未配平),下列叙述错误的是( )
A. 生成1mol Mn2+,转移电子为5mol
B. 该反应中氮元素被氧化
C. 配平后,水的化学计量数为3
D. 反应中氧化产物与还原产物的物质的量之比为2:5
难度: 中等查看答案及解析
-
中华民族的发明创造为人类文明进步做出了巨大贡献。下列我国古代发明中,不涉及化学反应的是( )
A.铜的冶炼 B.粮食酿醋
C.打磨磁石制指南针 D.火药的发明与使用
难度: 中等查看答案及解析
-
已知金属钠投入水中会发生剧烈反应,并有氢气生成。运输金属钠的包装箱应贴有的图标是( )
A.易燃液体
 B.遇湿易燃物品
B.遇湿易燃物品
C.氧化剂
 D.腐蚀品
D.腐蚀品
难度: 中等查看答案及解析
-
以下关于化学实验中“先”与“后”的说法错误的是( )
A.加热试管时,先均匀加热,后局部加热
B.做H2还原CuO实验时,先通H2,后加热CuO
C.点燃可燃性气体时,先检验气体纯度,后点燃
D.进行分液操作时,先从分液漏斗上口倒出上层液体,后通过下端活塞放出下层液体
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4L氦气与1mol氢气所含原子数均为2NA
B.25℃,101kPa时,22.4L氮气中含有的原子数为2NA
C.常温常压下,O2和O3的混合物共64g,所含氧原子数一定为4NA
D.将100mL1mol·L-1FeCl3溶液滴入沸水中,可制得Fe(OH)3胶粒数目为0.1NA的胶体
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.铁片插入氯化铁溶液中:Fe+Fe3+=Fe2+
B.稀硫酸与氢氧化钡溶液混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.稀盐酸滴在铜片上:2H++Cu=Cu2++H2↑
D.石灰石投入稀硝酸中:CaCO3+2H+=Ca2++H2O+CO2↑
难度: 中等查看答案及解析
-
有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸 B.氨水 C.NaOH溶液 D.KSCN溶液
难度: 中等查看答案及解析
-
下列关于铁及其化合物的说法正确的是( )
A.硫酸铁溶液不具有净水作用
B.Fe3O4是一种红棕色粉末,俗称磁性氧化铁
C.铁粉与水蒸气在加热条件下的反应产物为Fe2O3和H2
D.去除FeCl2溶液中的FeCl3,杂质.可以向溶液中加入过量铁粉.然后过滤
难度: 中等查看答案及解析
-
下列有关Na2CO3和NaHCO3的说法正确的是( )
A.在水中溶解度:Na2CO3<NaHCO3
B.二者都能与盐酸反应生成CO2
C.热稳定性:Na2CO3<NaHCO3
D.二者在相同条件下可相互转化
难度: 中等查看答案及解析
-
浓硫酸是实验室必备的重要试剂,下列有关它的说法错误的是
A.具有强腐蚀性 B.能使蔗糖变黑
C.能用于干燥氨气 D.加热时能与铜发生反应了
难度: 中等查看答案及解析
-
下列关于硅及其化合物的用途正确的是( )
A.高纯单质硅用于制光导纤维
B.二氧化硅用于制太阳能电池
C.硅酸钠溶液是制木材防火剂的原料
D.硅胶常用作瓶装药品的抗氧剂
难度: 中等查看答案及解析
-
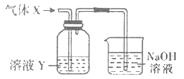
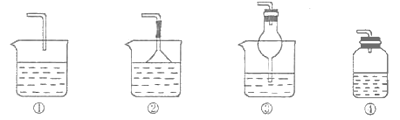
用如图所示装置进行实验,下列对试管①中的试剂及实验现象的解释不合理的是( )

A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某温度下将Cl。通人KOH溶液里,反应后得到KC1、KC1O、KC1O3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为3:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的质量之比为( )
A.1 : 3 B.4 : 3 C.2 : 1 D.3 : 1
难度: 困难查看答案及解析
-
现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol·L-1NaOH溶液,得到沉淀的物质的量与加入NaOH溶液的体积如图所示。原溶液中Cl-与SO42-的物质的量之比为( )

A.6:1 B.1:3 C.2:3 D.3:1
难度: 中等查看答案及解析