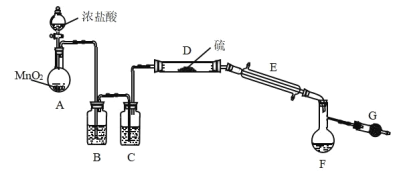
-
下列说法错误的是
A.《天工开物》中“凡石灰,经火焚炼为用,这里”涉及的反应类型是分解反应
B.“用浓酒和糟入甑(蒸锅),蒸令气上,用器承滴露”涉及的操作是蒸馏
C.《本草图经》在绿矾项载:“盖此矾色绿,味酸,烧之则赤…”因为绿矾能电离出 H+, 所以“味酸”
D.我国晋朝傅玄的《傅鹑觚集·太子少傅箴》中写道:“夫金木无常,方园应行,亦有隐括, 习与性形。故近朱者赤,近墨者黑。”这里的“朱”指的是 HgS
难度: 中等查看答案及解析
-
NA 为阿伏加德罗常数的值。下列说法正确的是( )
A.18gD2O 和 18gH2O 中含有的质子数均为 10NA
B.12 g 石墨烯(单层石墨)中含有六元环的个数为 0.5 NA
C.标准状况下,5.6LCO2 与足量 Na2O2 反应转移的电子数为0.5 NA
D.某密闭容器盛有 1 mol N2 和 3 mol H2,在一定条件下充分反应,转移电子的数目为 6NA
难度: 困难查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为直线型的共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
难度: 中等查看答案及解析
-
下图为一定条件下采用多孔惰性电极的储氢电池充电装置(忽略其他有机物)。已知储氢装置的电流效率
 ×100%,下列说法不正确的是
×100%,下列说法不正确的是
A.采用多孔电极增大了接触面积,可降低电池能量损失
B.过程中通过C-H键的断裂实现氢的储存
C.生成目标产物的电极反应式为C6H6+6e-+6H+===C6H12
D.若
=75%,则参加反应的苯为0.8mol
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是
A.疫苗一般应冷藏存放,目的是避免蛋白质变性
B.分子式为 C3H4Cl2 的同分异构体共有 4 种(不考虑立体异构)
C.有机物呋喃(结构如图所示
),,从结构上看,四个碳原子不可能在同一平面上
D.高分子均难以自然降解
难度: 中等查看答案及解析
-
下列实验不能达到目的的是
选项
目的
实验
A
制取 84 消毒液
将 Cl2 通入 NaOH 溶液中
B
防止采摘下来的水果过早变烂
保存在含有高锰酸钾的硅藻土箱子里
C
除去乙酸乙酯中的少量乙酸
加入饱和碳酸钠溶液洗涤、分液
D
分离氢氧化铁胶体与 FeCl3 溶液
通过滤纸过滤
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某二元弱碱B(OH)2(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀B(OH)2溶液中滴加等浓度盐酸溶液,B(OH)2、B(OH)+、B2+的浓度分数δ随溶液POH[POH=-lgc(OH)-]变化的关系如图,以下说法正确的是
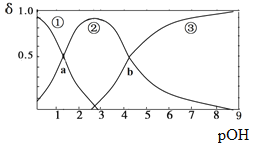
A.交点a处对应加入的盐酸溶液的体积为5mL
B.当加入的盐酸溶液的体积为10mL时存在c(Cl-)>c(B(OH)+)>c(H+)>c(OH-)>c(B2+)
C.交点b处c(OH)=6.4×10-5
D.当加入的盐酸溶液的体积为15mL时存在:c(Cl-)+c(OH-)= c(B2+)+c(B(OH)+)+ c(H+),
难度: 中等查看答案及解析