-
厨房中有很多调味品,它们可以补充食品在加工过程中失去的味道、增强原有的味道或添加一些额外的味道。下列说法不正确的是
A.醋能增加食品的酸味,还具有防腐作用
B.人体需控制食盐摄入量,以降低患高血压的风险
C.味精的主要成分是谷氨酸的钠盐,谷氨酸属于氨基酸
D.白砂糖的主要成分是蔗糖,蔗糖属于天然高分子化合物
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是
A.1L0.1mol·L-1Fe2(SO4)3溶液中含有的阳离子数目小于0.2NA
B.0.24g Mg在O2和CO2的混合气体中完全燃烧,转移电子数为0.02NA
C.3g由CO2和SO2组成的混合气体中含有的质子数为1.5NA
D.1molNa2O2与SO2完全反应,转移电子数为2NA
难度: 中等查看答案及解析
-
2019年9月25日,北京大兴国际机场正式投入运营。在这一形似“凤凰展翅”的宏伟建筑中,使用了大量种类各异的材料。下列关于所使用材料的分类不正确的是
选项
A
B
C
D
材料

含钒钢筋

安检塑料筐

有机玻璃标牌

玻璃钢内筒垃圾桶
分类
合金材料
高分子材料
无机硅酸盐材料
复合材料
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
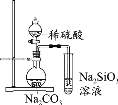
硫酰氯(SO2Cl2)可用于有机合成和药物制造等。实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2[SO2(g)+Cl2(g)
SO2Cl2(l) ΔH= -97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法错误的是

A.乙装置中盛放的试剂是P2O5,防止水蒸气进入装置中
B.装置甲应置于冰水浴中,目的是提高SO2Cl2产率
C.反应结束后,分离甲中混合物的实验操作是蒸馏
D.SO2、Cl2均可使品红试液褪色,原理不相同
难度: 中等查看答案及解析
-
泛酸和乳酸均易溶于水并能参与人体代谢,结构简式如下图所示。下列说法不正确的是
泛酸
 乳酸
乳酸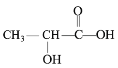
A.泛酸分子式为C9H17NO5
B.泛酸在酸性条件下的水解产物之一与乳酸互为同系物
C.泛酸易溶于水,与其分子内含有多个羟基易与水分子形成氢键有关
D.乳酸在一定条件下反应,可形成六元环状化合物
难度: 中等查看答案及解析
-
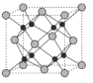
下列各项叙述中,正确的是
A.价电子排布为ns1的元素,不一定是s区元素
B.配合物Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n=5
C.光卤气(COCl2)、甲醛分子的立体构型和键角均相同
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE
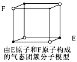
难度: 中等查看答案及解析
-
下列实验中,能达到相应实验目的的是

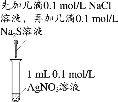
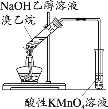
A.制备并收集乙酸乙酯
B.证明氯化银溶解度大于硫化银
C.验证溴乙烷的消去产物是乙烯
D.推断S、C、Si的非金属性强弱
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
二氧化碳捕获技术用于去除气流中的二氧化碳或者分离出二氧化碳作为气体产物,其中CO2催化合成甲酸是原子利用率高的反应,且生成的甲酸是重要化工原料。下列说法不正确的是( )
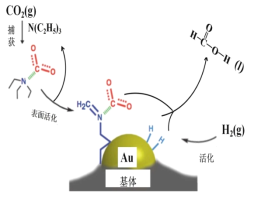
A.二氧化碳的电子式:
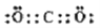
B.在捕获过程,二氧化碳分子中的共价键完全断裂
C.N(C2H5)3能够协助二氧化碳到达催化剂表面
D.CO2催化加氢合成甲酸的总反应式:H2+CO2=HCOOH
难度: 中等查看答案及解析
-
骨胶黏剂是一种极具应用前景的医用高分子材料。某骨胶黏剂的制备原料为聚酯三元醇,其合成原理如下:
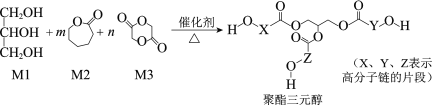
已知:R1COOR2+R318OH
R1CO18OR3+R2OH
下列说法不正确的是
A.单体M1可用于配制化妆品
B.改变M1在三种单体中的比例,可调控聚酯三元醇的相对分子质量
C.该合成反应为缩聚反应
D.X、Y、Z中包含的结构片段可能有
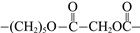
难度: 中等查看答案及解析
-
以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
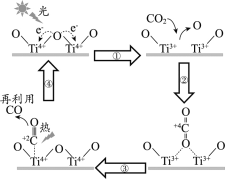
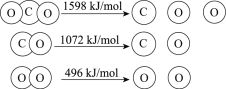
下列说法正确的是
A.过程①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.CO2分解反应的热化学方程式为2CO2(g) =2CO(g) + O2(g) ΔH= + 30 kJ/mol
难度: 中等查看答案及解析
-
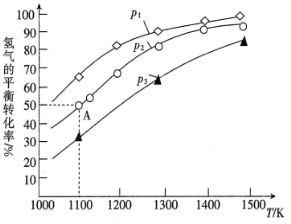
已知酸性 K2Cr2O7 溶液可与 FeSO4 溶液反应生成 Fe3+和 Cr3+。现将硫酸酸化的 K2Cr2O7 溶液与 FeSO4 溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的 KI 的物质的量的变化关系如图所示,下列不正确的是
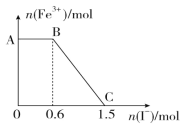
A.图中 AB 段的氧化剂为 K2Cr2O7
B.开始加入的 K2Cr2O7 为 0.25 mol
C.图中 BC 段发生的反应为 2Fe3++2I-=2Fe2++I2
D.混合之前,K2Cr2O7 与 FeSO4 的物质的量之比为 1:6
难度: 中等查看答案及解析
-
研究苯酚与 FeCl3 溶液的显色反应,实验如下:
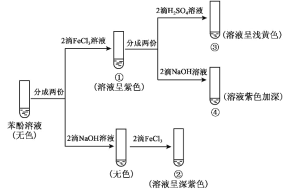
下列说法不正确的是( )
A.苯酚属于弱酸,电离方程式为
⇌
+H+
B.向试管②中滴加硫酸至过量,溶液颜色变为浅黄色
C.对比①③中的现象说明,滴加稀硫酸后,c(Fe3+)变小
D.对比①②、①④中的现象,说明紫色物质的生成与溶液中c(
)相关
难度: 中等查看答案及解析
-
用 AG 表示溶液酸度:AG=lg
。常温下,用 0.1 mol·L-1 的 NaOH 溶液滴定 25 mL 0.1 mol·L-1 的 CH3COOH。滴定结果可表示如图,下列分析正确的是( )
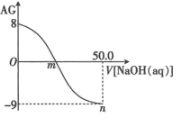
A.常温下 CH3COOH 的 Ka 数量级为 10-6
B.m 点加入 NaOH 的体积为 25 mL
C.n 点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.在滴加 NaOH 溶液的过程中,溶液中 m 点水的电离程度最大
难度: 中等查看答案及解析



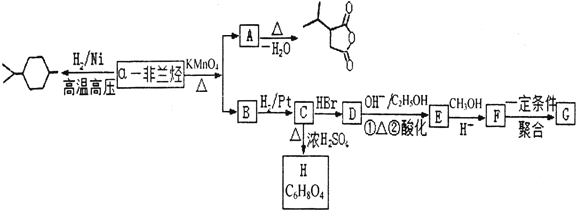
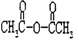
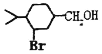 为原料合成
为原料合成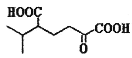 ______。(用流程图表示,其他无机试剂任选)
______。(用流程图表示,其他无机试剂任选)