-
下列过程一定不能自发进行的是( )
A.2N2O5(g)=4NO2(g)+O2(g) ΔH>0
B.2H2(g)+O2(g)=2H2O(l) ΔH<0
C.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ΔH>0
D.2CO(g)=2C(s)+O2(g) ΔH>0
难度: 简单查看答案及解析
-
下列事实:
①NaHSO4溶液呈酸性;②长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结;③配制CuCl2溶液,用稀盐酸溶解CuCl2固体;④NaHS溶液中c(H2S)>c(S2-);⑤氯化铵溶液可去除金属制品表面的锈斑;⑥加热FeCl3·6H2O晶体,往往得不到FeCl3固体。
其中与盐类的水解有关的叙述有( )
A. 6项 B. 5项 C. 3项 D. 4项
难度: 简单查看答案及解析
-
下列说法不正确的是
A.化学反应除了生成新物质外,还伴随着能量的变化
B.化学反应是放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量
C.吸热反应在一定条件(如高温、加热等)下也能发生
D.放热的反应在常温下一定很容易发生
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.由“C(石墨)=C(金刚石) ΔH= +1.9kJ·mol-1”可知,金刚石比石墨稳定
B.500℃、30M Pa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g) ΔH= -38.6kJ·mol-1
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ
D.X(g)+Y(g)
Z(g) ΔH >0,恒温恒容条件下达到平衡后加入X,上述反应ΔH增大
难度: 中等查看答案及解析
-
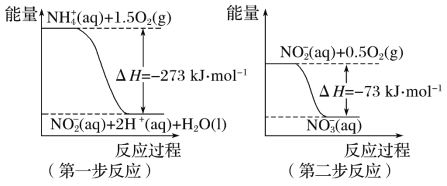
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O
Cd(OH)2 + 2Ni(OH)2 ,有关该电池的说法正确的是
A. 放电时电解质溶液中的OH-向正极移动
B. 充电过程是化学能转化为电能的过程
C. 放电时负极附近溶液的碱性增强
D. 充电时阳极反应:Ni(OH)2-e- + OH- = NiOOH + H2O
难度: 简单查看答案及解析
-
设C+CO2
CO(正反应为吸热反应),反应速率为v1;N2+3H2
2NH3(正反应为放热反应),反应速率为v2。对于上述反应,当温度升高时,v1和v2变化情况为( )
A.同时增大 B.同时减小 C.v1增大,v2减小 D.v1减小,v2增大
难度: 中等查看答案及解析
-
一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)
2NH3(g) ΔH<0,反应过程如图,下列说法正确的是( )
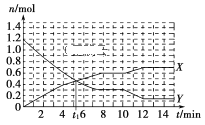
A.t1 min时正、逆反应速率相等
B.X曲线表示NH3的物质的量随时间变化的关系
C.0~8min,H2的平均反应速率v(H2)=
mol·L-1·min-1
D.10min,改变条件为升温
难度: 简单查看答案及解析
-
稀氨水中存在着下列平衡:NH3·H2O
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgCl2固体。
A.①②③⑤ B.③⑥ C.③ D.③⑤
难度: 简单查看答案及解析
-
下列溶液肯定显酸性的是
A.
的溶液 B. 含
的溶液
C.
的溶液 D. 加酚酞显无色的溶液
难度: 简单查看答案及解析
-
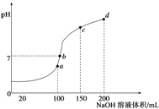
在25mL0.1mol·L-1某一元碱中,逐滴加入0.1mol·L-1醋酸,滴定曲线如图所示。则下列说法不正确的是
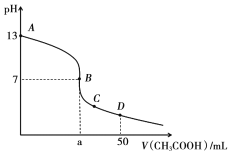
A.该碱溶液可以溶解Al(OH)3
B.a点对应的体积值大于25mL
C.C点时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.D点时,c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH)
难度: 简单查看答案及解析
-
下列有关实验操作的叙述正确的是( )
A.中和滴定实验中指示剂不宜加入过多,通常控制在 1mL 至 2mL
B.在50mL碱式滴定管中装氢氧化钠溶液至5mL刻度处,把液体全部放入烧杯,液体体积为 45mL
C.碱式滴定管可以用来装碱性和氧化性的溶液
D.用标准盐酸测定未知浓度NaOH结束实验时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡,所测结果偏低
难度: 简单查看答案及解析
-
下列离子组因发生双水解反应而不能大量共存的是
A. Ba2+、NH4+、SO42-、OH- B. H+、Na+、NO3-、I-
C. Al3+、K+、HCO3-、NO3- D. H+、Ca2+、CO32-、Cl-
难度: 简单查看答案及解析
-
的两种一元酸
和
,体积均为
,稀释过程中
与溶液体积的关系如图所示。分别滴加
溶液(
)至
,消耗
溶液的体积为
、
,则( )

A.
为弱酸,
B.
为强酸,
C.
为弱酸,
D.
为强酸,
难度: 中等查看答案及解析
-
在
时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知
时硫酸钙的Ksp=9.1×10-6,下列说法正确的是( )

A.除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除
B.图中b点碳酸钙的结晶速率小于其溶解速率
C.通过蒸发,可使溶液由a点变化到c点
D.在25℃时,反应
的平衡常数K=3500
难度: 简单查看答案及解析
-
如图是一套电化学装置,对其有关说法错误的是( )
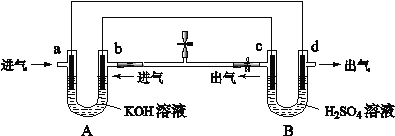
A.装置A是原电池,装置B是电解池
B.反应一段时间后,装置B中溶液pH增大
C.a若消耗1mol CH4,d可产生4mol气体
D.a通入C2H6时的电极反应为 C2H6-14e-+ 18OH-= 2CO32-+ 12H2O
难度: 中等查看答案及解析
-
现代膜技术可使某种离子具有单向通过能力,常用于电解池、原电池中。电解NaB(OH)4溶液可制备H3BO3,其工作原理如图。下列叙述错误的是( )

A.M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B.N室:a<b
C.产品室发生的反应是[B(OH)4]- +H+
H3BO3+H2O
D.理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
难度: 中等查看答案及解析