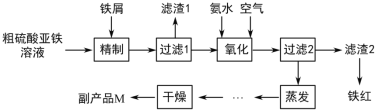
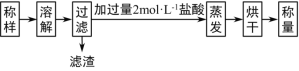-
化学与生活密切相关,下列说法错误的是
A.Na2CO3用于制胃酸中和剂 B.FeSO4用于制补铁剂
C.硬铝合金用于制造飞机和宇宙飞船 D.14C用于测定文物年代
难度: 简单查看答案及解析
-
科学家为人类社会的进步做出了巨大贡献,下列研究成果与科学家对应关系不符合事实的是
A.侯德榜发明的侯氏制碱法推动了我国制碱工业的发展
B.屠呦呦为提取抗疟药青蒿素做出卓越贡献而获得诺贝尔奖
C.门捷列夫发现元素周期律,使化学的研究变得有规律可循
D.道尔顿提出分子学说,使人们对物质结构的认识发展到一个新的阶段
难度: 简单查看答案及解析
-
下列有关物质的储存及处理方法错误的是
A.常温时液氯用钢瓶储存 B.未用完的钠、钾放回原试剂瓶
C.尾气中氯气用烧碱溶液吸收 D.氧化性和还原性废弃物混合后直接排放
难度: 简单查看答案及解析
-
下列关于合金的说法中,正确的是
A.合金的熔点一定比各成分金属的低
B.钢是目前用量最大、用途最广的合金
C.在我国使用最早的合金是生铁
D.储氢合金能大量吸收H2,但不与H2反应
难度: 简单查看答案及解析
-
13C-NMR(核磁共振)可用于含碳化合物的结构分析,15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下列有关13C、15N的叙述正确的是
A.13C与15N具有相同的中子数 B.13C与14C的核外电子排布不同
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
难度: 简单查看答案及解析
-
下列关于溶液和胶体的叙述中错误的是
A.溶液是混合物,胶体是纯净物 B.胶体粒子的直径为10-9~10-7m
C.溶液和胶体均呈电中性 D.利用丁达尔效应可区分溶液和胶体
难度: 简单查看答案及解析
-
数字化实验是利用传感器和信息处理终端进行数据采集与分析的实验手段。下图是利用数字化实验测定光照氯水过程中得到的图像,该图像表示的意义是
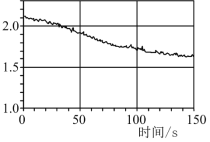
A.氯离子浓度随时间的变化
B.氧气体积分数随时间的变化
C.氯水的pH随时间的变化
D.氯水导电能力随时间的变化
难度: 简单查看答案及解析
-
下列实验中的颜色变化与氧化还原反应有关的是
A.向沸水中滴入几滴饱和FeCl3溶液,液体呈红褐色
B.向氯水中滴入几滴石蕊试液,溶液先变红后褪色
C.向FeCl3溶液中滴入几滴KSCN溶液,溶液变红色
D.向Na2CO3溶液中滴入几滴酚酞试液,溶液变红色
难度: 简单查看答案及解析
-
下列离子在强碱性溶液中能大量共存的是
A.Mg2+、Na+、NO3-、SO42- B.Na+、K+、ClO-、I-
C.Na+、K+、HCO3-、SO42- D.Ba2+、Na+、Cl-、NO3-
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.铜和氯化铁溶液反应:Fe3++ Cu=Fe2++ Cu2+
B.钠和水反应:2Na + 2H2O=2Na++ 2OH-+ H2↑
C.大理石和稀盐酸反应:2H++ CO32-=CO2↑+ H2O
D.硫酸和氢氧化钡溶液反应:H++ SO42-+ Ba2++ OH-=BaSO4↓+ H2O
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列说法正确的是
A.0.5 mol•L-1硫酸溶液中含有的H+数目为NA
B.标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA
C.1.0 mol NaCl中,所有Na+的最外层电子数之和为8 NA
D.常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA
难度: 简单查看答案及解析
-
氢化钠(NaH)可在野外用作生氢剂,其中氢元素为-1价。NaH用作生氢剂时的化学反应原理为:NaH + H2O=NaOH + H2↑。下列说法中正确的是
A.该反应属于复分解反应 B.H2O中的氢元素被还原
C.NaH是氧化剂 D.被氧化的元素与被还原的元素质量比为1:2
难度: 简单查看答案及解析
-
下列说法错误的是
A.O2-、F-、Na+、Mg2+半径依次减小
B.O2和O3是氧元素的同素异形体
C.同一元素的不同核素化学性质几乎完全相同
D.同主族元素含氧酸的酸性随核电荷数的增加而减弱
难度: 简单查看答案及解析
-
消毒剂的消毒效率可用单位质量消毒剂被还原时得电子数表示,即得电子数越多,消毒效率越高。NaClO与ClO2均可用作消毒剂(反应后氯元素均为-1价),则ClO2的消毒效率是NaClO的
A.2.5倍 B.2.63倍 C.2.76倍 D.3.02倍
难度: 简单查看答案及解析