-
中华优秀传统文化涉及到很多的化学知识。下列有关说法不正确的是( )
A.宋代梅尧臣的《陶者》“陶尽门前土,屋上无片瓦。十指不沾泥,鳞鳞居大厦。”黏土烧制陶瓷的过程中没有发生化学变化
B.古代炼丹著作《黄白第十六》中“曾青涂铁,铁赤如铜”,该反应类型为置换反应
C.东汉魏伯阳在《周易参同契》中对汞的描述.“……得火则飞,不见埃尘,将欲制之,黄芽为根。”这里的“黄芽”指的是硫黄
D.明代李时珍《本草纲目》中“自元时始创其法,用浓酒和糟入甑,蒸令气上,用器承滴露”,其“法”是指蒸馏
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列叙述正确的是( )
A.10mL18mol/L的浓硫酸与足量的铜加热充分反应,转移电子数0.18NA
B.钾在空气中燃烧可生成多种氧化物,78g钾在空气中燃烧时转移的电子数为2NA
C.常温常压下,0.1molNH3与0.1molHCl充分反应后所得的产物中含有的分子数仍为0.1NA
D.标准状况下,22.4LCO2中含有共用电子对数为2NA
难度: 简单查看答案及解析
-
维生素C是广泛存在于新鲜水果蔬菜及许多生物中的一种重要的维生素,作为一种高活性物质,它参与许多新陈代谢过程。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
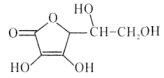 +I2
+I2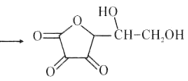 +2HI
+2HI下列说法正确的是( )
A.上述反应说明维生素C能使碘水褪色,该反应的反应类型为取代反应
B.维生素C可发生取代反应、加成反应、氧化反应
C.维生素C可以水解得到2种产物
D.维生素C不可溶于水,可以溶于有机溶剂
难度: 简单查看答案及解析
-
我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下,则下列说法正确的是( )
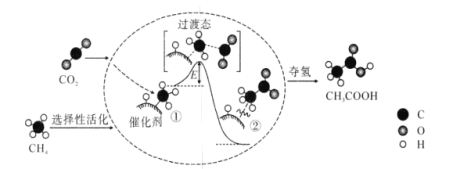
A.E为该反应的反应热
B.①→②吸收能量
C.CH4→CH3COOH过程中,有极性键的断裂和非极性键的形成
D.加入催化剂能改变该反应的能量变化
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,其中两种元素形成的化合物可用于呼吸面具中作为供氧剂。W、X、Y三种元素形成的一种化合物常用于清洗厨房用具的油污,Z的最外层电子数为X、Y的最外层电子数之和。下列说法不正确的是( )
A.X、Z的某些单质或两元素之间形成的某些化合物可作水的消毒剂
B.化合物Y2X2和YZX都既存在离子键,又存在共价键
C.原子半径大小:W>X;简单离子半径:Y<Z
D.W与X能形成多种化合物,都能与Y的最高价氧化物的水化物溶液发生反应
难度: 中等查看答案及解析
-
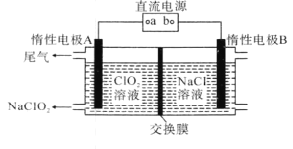
我国对二氧化硫一空气质子交换膜燃料电池的研究处于世界前沿水平,该电池可实现硫酸生产、发电和环境保护三位一.体的结合。其原理如图所示。下列说法不正确的是( )
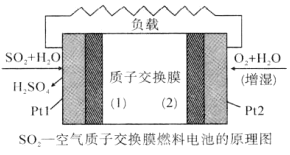
A.Pt1电极附近发生的反应为:SO2+2H2O-2e-=H2SO4+2H+
B.相同条件下,放电过程中消耗的SO2和O2的体积比为2:1
C.该电池工作时质子从Pt1电极经过内电路流到Pt2电极
D.该电池实现了制硫酸、发电、环保三位一体的结合
难度: 简单查看答案及解析
-
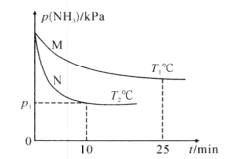
在25°C时,向amL0.10mol·L-1的HNO2溶液中逐滴加入0.10mol·L-1的NaOH溶液。滴定过程中混合溶液的pOH[pOH=-lgc(OH-)]与NaOH溶液的体积V的关系如图所示。已知P点溶液中存在c(OH-)=c(H+)+c(HNO2),下列说法不正确的是( )
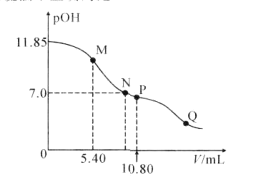
A.25°C时,HNO2电离常数的数量级是10-4
B.M点溶液中存在:2c(H+)+c(HNO2)=c(OH-)+c(NO2-)
C.图上M、N、P、Q四点溶液中所含离子的种类相同
D.a=10.80
难度: 中等查看答案及解析
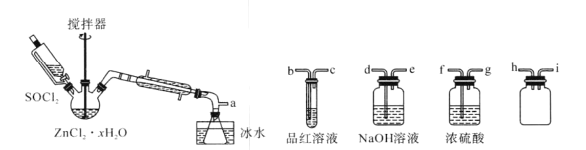
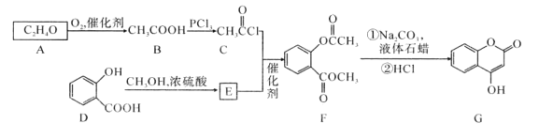
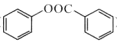 )是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选):___。
)是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选):___。