-
锌锰干电池的负极是作为电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生 MnOOH。废旧电池中的Zn、Mn元素的回收,对环境保护有重要的意义。
Ⅰ. 回收锌元素,制备ZnCl2
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得固体和滤液。
步骤二:处理滤液,得到ZnCl2·xH2O晶体。
步骤三:将SOCl2与ZnCl2·xH2O晶体混合制取无水ZnCl2。
制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略) 的装置如下:

(已知: SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃,140℃以上时易分解,与水剧烈水解生成两种气体。)
(1)写出SOCl2与水反应的化学方程式:______________________。
(2)接口的连接顺序为a→___→___→ h → h →___→___→___→e。______________
Ⅱ. 回收锰元素,制备MnO2
(3)洗涤步骤一得到的固体,判断固体洗涤干净的方法:_________________________。
(4)洗涤后的固体经初步蒸干后进行灼烧,灼烧的目的__________________________。
Ⅲ. 二氧化锰纯度的测定
称取1.40g灼烧后的产品,加入2.68g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参与反应),充分反应后冷却,将所得溶液转移到100mL容量瓶中用蒸馏水稀释至刻线,从中取出20.00mL,用0.0200mol/L高锰酸钾溶液进行滴定,滴定三次,消耗高锰酸钾溶液体积的平均值为17.30mL。
(5)写出MnO2溶解反应的离子方程__________________________________________。
(6)产品的纯度为______________________ 。
(7)若灼烧不充分,滴定时消耗高锰酸钾溶液体积_____(填“偏大”、“ 偏小”、“ 不变”)。
-
锌锰干电池的负极是作为电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生 MnOOH。废旧电池中的Zn、Mn元素的回收,对环境保护有重要的意义。
Ⅰ. 回收锌元素,制备ZnCl2
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得固体和滤液。
步骤二:处理滤液,得到ZnCl2·xH2O晶体。
步骤三:将SOCl2与ZnCl2·xH2O晶体混合制取无水ZnCl2。
制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略) 的装置如下:
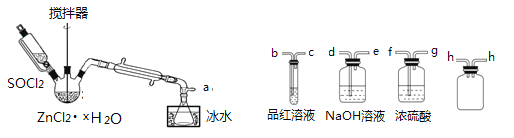
(已知: SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃,140℃以上时易分解,与水剧烈水解生成两种气体。)
(1)写出SOCl2与水反应的化学方程式:______________________。
(2)接口的连接顺序为a→___→___→ h → h →___→___→___→e。______________
Ⅱ. 回收锰元素,制备MnO2
(3)洗涤步骤一得到的固体,判断固体洗涤干净的方法:_________________________。
(4)洗涤后的固体经初步蒸干后进行灼烧,灼烧的目的__________________________。
Ⅲ. 二氧化锰纯度的测定
称取1.40g灼烧后的产品,加入2.68g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参与反应),充分反应后冷却,将所得溶液转移到100mL容量瓶中用蒸馏水稀释至刻线,从中取出20.00mL,用0.0200mol/L高锰酸钾溶液进行滴定,滴定三次,消耗高锰酸钾溶液体积的平均值为17.30mL。
(5)写出MnO2溶解反应的离子方程__________________________________________。
(6)产品的纯度为______________________ 。
(7)若灼烧不充分,滴定时消耗高锰酸钾溶液体积_____(填“偏大”、“ 偏小”、“ 不变”)。
-
锌锰干电池的负极是作为电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生 MnOOH。废旧电池中的Zn、Mn元素的回收,对环境保护有重要的意义。
Ⅰ. 回收锌元素,制备ZnCl2
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得固体和滤液。
步骤二:处理滤液,得到ZnCl2·xH2O晶体。
步骤三:将SOCl2与ZnCl2·xH2O晶体混合制取无水ZnCl2。
制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略) 的装置如下:
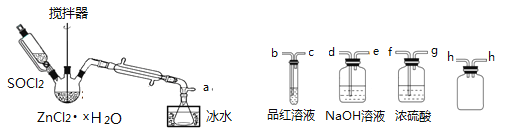
(已知: SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃,140℃以上时易分解,与水剧烈水解生成两种气体。)
(1)写出SOCl2与水反应的化学方程式:______________________。
(2)接口的连接顺序为a→___→___→ h → h →___→___→___→e。______________
Ⅱ. 回收锰元素,制备MnO2
(3)洗涤步骤一得到的固体,判断固体洗涤干净的方法:_________________________。
(4)洗涤后的固体经初步蒸干后进行灼烧,灼烧的目的__________________________。
Ⅲ. 二氧化锰纯度的测定
称取1.40g灼烧后的产品,加入2.68g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参与反应),充分反应后冷却,将所得溶液转移到100mL容量瓶中用蒸馏水稀释至刻线,从中取出20.00mL,用0.0200mol/L高锰酸钾溶液进行滴定,滴定三次,消耗高锰酸钾溶液体积的平均值为17.30mL。
(5)写出MnO2溶解反应的离子方程__________________________________________。
(6)产品的纯度为______________________ 。
(7)若灼烧不充分,滴定时消耗高锰酸钾溶液体积_____(填“偏大”、“ 偏小”、“ 不变”)。
-
废旧电池中的Zn、Mn元素的回收,对环境保护有重要的意义。锌锰干电池的负极是作为电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生MnOOH。
I.回收锌元素,制备ZnCl2
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得固体和滤液;
步骤二:处理滤液,得到ZnCl2·xH2O晶体;
步骤三:将SOCl2与ZnCl2·xH2O晶体混合制取无水ZnCl2。
制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)的装置如下:
已知:SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃,140℃以上时易分解,与水剧烈水解生成两种气体。
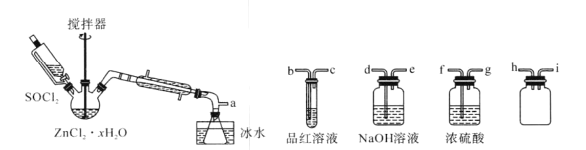
(1)接口的连接顺序为a→___→____→h→i→___→___→___→e。
(2)三颈烧瓶中反应的化学方程式:____。
(3)步骤二中得到ZnCl2·xH2O晶体的操作方法:___。
(4)验证生成物中含有SO2的现象为:___。
II.回收锰元素,制备MnO2
(5)步骤一得到的固体经洗涤,初步蒸干后进行灼烧,灼烧的目的____。
III.二氧化锰纯度的测定
称取1.0g灼烧后的产品,加入1.34g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参与反应),充分反应后冷却,将所得溶液转移到100mL容量瓶中用蒸馏水稀释至刻度线,从中取出10.00mL,用0.0200mol/L高锰酸钾溶液进行滴定,滴定三次,消耗高锰酸钾溶液体积的平均值为10.00mL。
(6)写出MnO2溶解反应的离子方程式___。
(7)产品的纯度为____。
-
锌锰干电池的负极是作为电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生MnOOH。废旧电池中的Zn、Mn元素的回收,对环境保护有重要的意义。
Ⅰ.回收锌元素,制备ZnCl2
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得固体和滤液。
步骤二:处理滤液,得到ZnCl2·xH2O晶体。
步骤三:将SOCl2与ZnCl2·xH2O晶体混合制取无水ZnCl2。
制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)的装置如图:
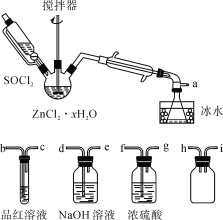
(已知:SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃,140℃以上时易分解,与水剧烈反应生成两种气体。)
(1)写出SOCl2与水反应的化学方程式:__。
(2)接口的连接顺序为a→__→__→h→i→__→__→__→e。
Ⅱ.回收锰元素,制备MnO2
(3)洗涤步骤一得到的固体,判断固体洗涤干净的方法:__。
(4)洗涤后的固体经初步蒸干后进行灼烧,灼烧的目的:__。
Ⅲ.二氧化锰纯度的测定
称取1.40g灼烧后的产品,加入2.68g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参与反应),充分反应后冷却,将所得溶液转移到100mL容量瓶中用蒸馏水稀释至刻线,从中取出20.00mL,用0.0200mol/L高锰酸钾溶液进行滴定,滴定三次,消耗高锰酸钾溶液体积的平均值为17.30mL。
(5)写出MnO2溶解反应的离子方程式__。
(6)产品的纯度为__。
(7)若灼烧不充分,滴定时消耗高锰酸钾溶液体积__(填“偏大”“偏小”“不变”)。
-
锌锰干电池的负极是作为电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生MnOOH。废旧电池中的Zn、Mn元素的回收,对环境保护有重要的意义。
Ⅰ.回收锌元素,制备ZnCl2
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得固体和滤液。
步骤二:处理滤液,得到ZnCl2·xH2O晶体。
步骤三:将SOCl2与ZnCl2·xH2O晶体混合制取无水ZnCl2。
制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)的装置如图:
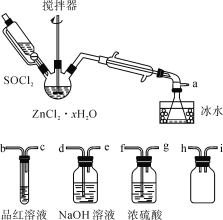
(已知:SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃,140℃以上时易分解,与水剧烈反应生成两种气体。)
(1)写出SOCl2与水反应的化学方程式:__。
(2)接口的连接顺序为a→__→__→h→i→__→__→__→e。
Ⅱ.回收锰元素,制备MnO2
(3)洗涤步骤一得到的固体,判断固体洗涤干净的方法:__。
(4)洗涤后的固体经初步蒸干后进行灼烧,灼烧的目的:__。
Ⅲ.二氧化锰纯度的测定
称取1.40g灼烧后的产品,加入2.68g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参与反应),充分反应后冷却,将所得溶液转移到100mL容量瓶中用蒸馏水稀释至刻线,从中取出20.00mL,用0.0200mol/L高锰酸钾溶液进行滴定,滴定三次,消耗高锰酸钾溶液体积的平均值为17.30mL。
(5)写出MnO2溶解反应的离子方程式__。
(6)产品的纯度为__。
(7)若灼烧不充分,滴定时消耗高锰酸钾溶液体积__(填“偏大”“偏小”“不变”)。
-
锌锰干电池的负极材料是电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生Mn2O3。利用废旧电池回收Zn、Mn化合物,对环境保护意义重大。
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得到固体和滤液。
步骤二:处理固体,提取MnO2通过对获得的滤渣进行灼烧,灼烧的目的是__。灼烧时用到的实验仪器有酒精灯、玻璃棒、__。
步骤三:处理滤液,得到ZnCl2·xH2O晶体,再通过将SOCl2与ZnCl2·xH2O晶体混合可制取无水ZnCl2。有关的实验装置如图(夹持及加热装置略):
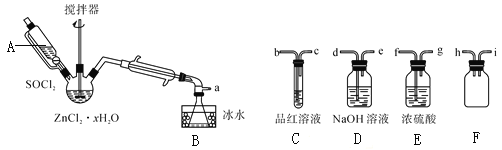
已知:SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃。140℃以上易分解,与水剧烈反应生成两种气体。
①仪器A的名称为__。
②蒸馏烧瓶中发生反应的化学方程式为:__。
③为回收剩余的SOCl2并验证生成物中含有SO2。上述仪器接目的连接响序为a→__。装置E中浓硫酸的作用___。
④为提高SOCl2的利用率,该实验宜采用的加热方式为__。
⑤讨论:将ZnCl2·xH2O晶体置于坩埚中加热均烧,__(能,不能)得到无水ZnCl2,原因是__。
-
Ni-MH电池在工农业生产和日常生活中具有广泛用途,废旧电池中含有大量金属元素,其回收利用具有非常重要的意义。一种利用废Ni-MH电池正极材料(主要含有Ni(OH)2,还含有少量Fe、Cu、Ca、Mg、Mn、Zn的氢氧化物)制备电子级硫酸镍晶体的工艺流程如下图所示:

回答下列问题:
(1)“浸出”时温度、硫酸浓度、浸出时间对镍浸出率的影响如下图:
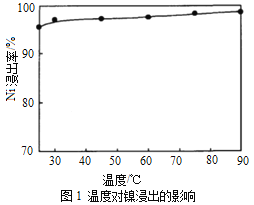
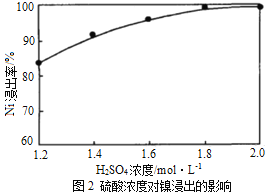
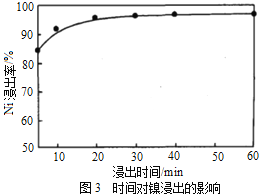
则“浸出”时最适宜的条件为_______________。
(2)在“滤液1”中加入双氧水可将Fe2+转化为难溶的针铁矿(FeOOH),写出反应的离子方程式:______________。
(3)“滤液2”中加入NaF 可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。当加入过量NaF后,所得“滤液3”中c(Mg2+)∶c(Ca2+)=0.67,则MgF2 的溶度积为_____________[已知Ksp(CaF2)=1.10×10-10]。
(4)向“滤液3”中加入(NH4)2S2O8可以除锰,在此过程中(NH4)2S2O8与MnSO4反应生成含锰元素的一种黑色不溶物、硫酸铵及硫酸,写出该反应的化学方程式___________________。
(5)向“滤液4”加入有机萃取剂后,Zn2+与有机萃取剂(用HA表示) 形成易溶于萃取剂的络合物ZnA2·2HA。该过程可以表示为:Zn2++4HA ZnA2·2HA+2H+
ZnA2·2HA+2H+
①已知加入萃取剂后,锌的萃取率随料液pH 变化如图所示。试分析pH 增大时,锌的萃取率逐渐增大的原因是___________________。
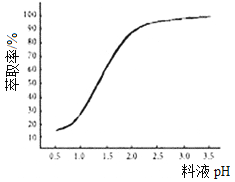
②“操作X”的名称是_____________。
(6)上述回收镍的过程中,使用了1kg 含镍37.1%的正极材料,最终得到纯净的NiSO4·7H2O 1.686kg,则镍的回收率为_______________。
-
金属是不可再生的资源,通过回收废旧的锂电池提取锂、铝、钴等重要的金属具有重大的意义。已知锂电池的正极材料为LiCoO2、炭黑、铝箔及有机粘合剂,下面是回收的工艺流程:
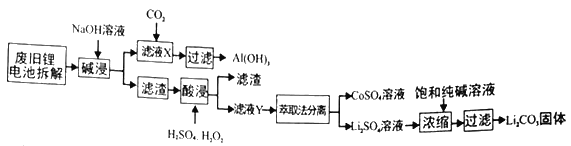
(1)滤液X中通入过量CO2时发生的主要反应的离子方程式为___________
(2)写出酸浸时加入H2SO4、H2O2反应的化学方程式______________________
(3)实验室中萃取分离CoSO4、Li2SO4溶液时需要加入有机物W,若实验过程中使用如图装置,则该装置中存在的主要错误有______________________

(4)已知部分物质的溶解度(g/100gH2O)情况如下表所示:

写出浓缩后的溶液中加入饱和碳酸钠溶液的离子反应方程式______________________;为提高Li2CO3的产率,最后过滤实验中需要注意的问题是______________________
(5)若废旧的锂电池拆解后先使用酸溶解,最终也可以得到Al(OH)3、CoSO4、Li2CO3。在酸浸中若Al3+浓度为0.1moL·L-1,则常温时pH>______________________才能够开始形成氢氧化铝沉淀(已知氢氧化铝Ksp=1.3×10-33、lg4.26=0.6、 =2.35)
=2.35)
(6)已知100g废旧的锂电池中钴酸锂(LiCoO2)的含量为9.8%,若按照上述生产流程,可以生成2.4gLi2CO3,则其产率为______________________。
-
(14分)
锂离子电池的广泛应用使回收利用锂资源成为重要课题。某研究性小组对废旧锂离子电池正极材料( 、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:
、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:
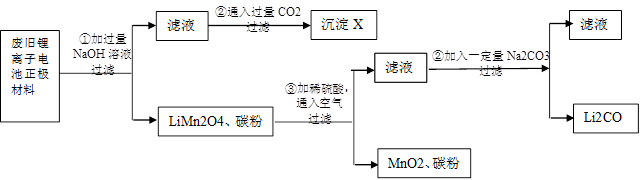
(1)第②步反应得到的沉淀X的化学式为________。
(2)第③步反应的离子方程式是________。
(3)第④步反应后,过滤 所需的玻璃仪器有________。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:________、。
所需的玻璃仪器有________。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:________、。
(4)若废旧锂离子电池正极材料含 的质量为18.1g,第③步反应中加入20.0ml3.0mol.
的质量为18.1g,第③步反应中加入20.0ml3.0mol. 的
的 溶液,假定正极材料中的锂经反应③和④完全转化为
溶液,假定正极材料中的锂经反应③和④完全转化为 ,则至少有________g
,则至少有________g 参加了反应。
参加了反应。















