-
中国不少古诗词清晰地描绘了当时人民的生活和社会的发展,如刘禹锡的《浪淘沙》:“日照澄州江雾开,淘金女伴满江隈。美人首饰侯王印,尽是沙中浪底来。”下列有关本诗中蕴含的化学知识正确的是( )
A.“沙中浪底来”指的是金的氧化物
B.淘金原理与化学上的萃取一致
C.雾的分散质粒子直径范围是10-9~10-7cm
D.由沙子到计算机芯片发生了还原反应
难度: 简单查看答案及解析
-
下列叙述中正确的是( )
A.分子式为C2H4和C8H16的两种有机物一定互为同系物
B.甲烷、苯、乙醇均不能使酸性KMnO4溶液褪色
C.糖类、油脂、蛋白质均能发生水解反应
D.乙烯和苯乙烯分子中所有原子均可能在同一平面上,都能使溴水褪色
难度: 简单查看答案及解析
-
下列实验方案能达到实验目的的是( )
选项
实验目的
实验方案
A
除去Al2O3中的Fe2O3
向固体中先加入过量NaOH溶液,过滤后向滤液中加入过量盐酸
B
验证Cu和浓硫酸反应生成CuSO4
向反应后溶液中加入水,观察到溶液变蓝色
C
证明二氧化硫具有还原性
将二氧化硫通入Ba(NO3)2溶液中,有白色沉淀生成
D
验证:Ksp(AgI)<Ksp(AgCl)
向盛有1mL0.1mol·L-1AgNO3溶液的试管中滴加10滴0.1mol·L-1NaCl溶液,有白色沉淀生成,向其中继续滴加0.1mol·L-1KI溶液,有黄色沉淀产生
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.42gC3H6中含有的共用电子对数为8NA
B.2gCaCO3和8gKHCO3组成的混合物中含碳原子数为0.1NA
C.标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA
D.1L0.01mol·L-1KAl(SO4)2溶液中含有的金属阳离子数为0.02NA
难度: 简单查看答案及解析
-
常温下,用0.1mol·L-1NaOH溶液滴定0.10 mol·L-1HA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列陈述错误的是
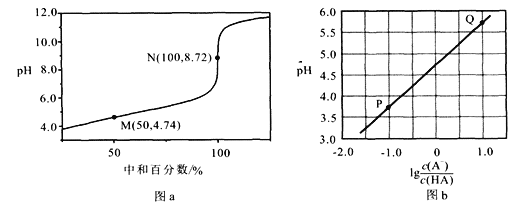
A.Ka(HA)的数量级为10-5
B.N点,c(Na+)-c(A-)=
C.P到Q过程中,水的电离程度逐渐增大
D.当滴定至溶液呈中性是,c(A-)>c(HA)
难度: 中等查看答案及解析
-
氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险。如图是氟离子电池工作示意图,其中充电时F-从乙电极流向甲电极,下列关于该电池的说法正确的是( )
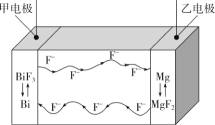
A.放电时,甲电极的电极反应式为Bi-3e-+3F-=BiF3
B.放电时,乙电极电势比甲电极高
C.充电时,导线上每通过1mole-,甲电极质量增加19g
D.充电时,外加电源的正极与乙电极相连
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W、Q原子序数依次增大,其中X是组成有机物的必要元素.Y的原子最外层电子数是其电子层数的3倍,W与X同主族,Z与Q最外层电子数相差6。下列说法正确的是
A. 非金属性:Q>Y>X>Z
B. 简单气态氢化物的沸点:X>W
C. Y与X、Z、Q均可形成至少两种二元化合物
D. Y、Z、Q组成化合物的水溶液呈碱性
难度: 中等查看答案及解析
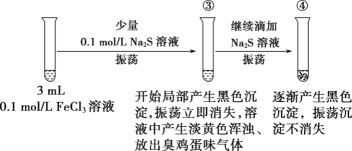
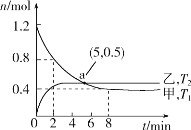

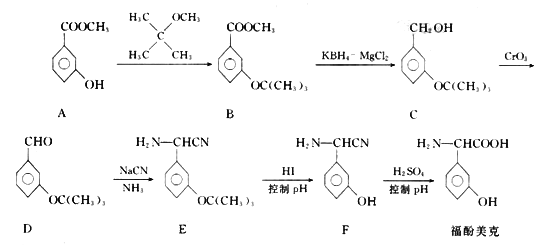
 的合成路线:___________。
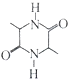
的合成路线:___________。