-
某学习小组同学进行实验探究FeCl3溶液和Na2S溶液的反应原理。
Ⅰ.学习小组的同学通过查阅以下资料和所学知识,预测产物。
资料:Fe2S3和FeS均为黑色、不溶于水、能溶于酸的固体,Fe2S3固体常温下易转变为黄绿色;H2S为有臭鸡蛋气味的气体。0.1mol/LNa2S溶液的pH约为12.9。
Ksp近似数据:Fe(OH)3为10-39,Fe2S3为10-88,FeS为10-19。
(1)同学甲计算出0.1mol/L的FeCl3溶液的pH约为__,依据酸碱理论的相关知识预测FeCl3与Na2S可能发生水解反应,则该反应的离子方程式为___。
(2)同学乙依据难溶电解质的溶解平衡理论的相关知识预测反应主要产生Fe2S3而不是Fe(OH)3的原因为__。
(3)同学丙依据氧化还原反应理论的相关知识预测FeCl3溶液与Na2S溶液反应可生成FeS和S的混合物,则反应的离子方程式为__。
Ⅱ.学习小组进行实验,探究反应生成沉淀物的成分。
实验一:
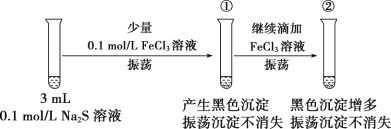
(4)某同学设计实验证明试管①中黑色物质含有Fe2S3,该同学的实验操作为_____。
(5)另一同学将试管②中黑色沉淀过滤洗涤后溶解于稀硫酸获得淡黄色悬浊液并闻到臭鸡蛋气味,判断沉淀为FeS和S的混合物,但有同学认为此判断不合理,请说明理由:__。
实验二:
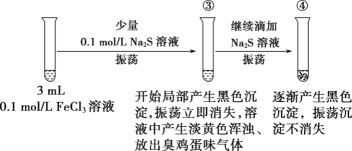
(6)若试管③中沉淀溶解现象是因为溶液酸性较强将产生的少量黑色沉淀溶解,用离子方程式表示溶液酸性较强的原因:__。
(7)FeCl3溶液和Na2S溶液间可发生复分解反应也可发生氧化还原反应,且反应的产物、实验的现象与__等有关(写出一条即可)。
-
某学习小组通过下列装置探究 MnO2与FeCl3·6H2O反应产物。
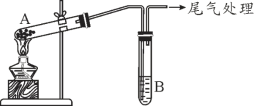
(查阅资料)FeCl3是一种共价化合物,熔点306℃,沸点315℃。
| 实验编号 | 操作 | 现象 |
| 实验 1 | 按上图所示,加热A中MnO2与FeCl3·6H2O混合物 | ①试管A中固体部分变液态,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中KI-淀粉溶液变蓝 |
| 实验 2 | 把A中的混合物换为FeCl3·6H2O,B中溶液换为KSCN溶液,加热。 | A中固体部分变液态,产生白雾和黄色气体,B中KSCN溶液变红 |
(实验探究)实验操作和现象如下表:
(问题讨论)
(1)实验前首先要进行的操作是______________________________。
(2)实验1和实验2产生的白雾是_______(填化学式)溶解在水中形成的小液滴。
(3)请用离子方程式解释实验2中黄色气体使KI-淀粉溶液变蓝色的原因_____________。
(4)为确认黄色气体中含有Cl2,学习小组将实验1中试管B内KI-淀粉溶液替换为NaBr溶液,发现B中溶液呈橙色,经检验无Fe2+,说明黄色气体中含有Cl2。用铁氰化钾溶液检验Fe2+的离子方程式是_________________________________。选择NaBr溶液的原因是________________________________________________________________。
(实验结论)
(5)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为____________________________________________________。
(实验反思)
该学习小组认为实验1中溶液变蓝,也可能是酸性条件下,I-被空气氧化所致,可以先将装置中的空气排尽,以排除O2的干扰。
-
某学习小组通过下列装置探究 MnO2与FeCl3·6H2O反应产物。
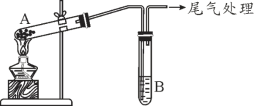
(查阅资料)FeCl3是一种共价化合物,熔点306℃,沸点315℃。
| 实验编号 | 操作 | 现象 |
| 实验 1 | 按上图所示,加热A中MnO2与FeCl3·6H2O混合物 | ①试管A中固体部分变液态,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中KI-淀粉溶液变蓝 |
| 实验 2 | 把A中的混合物换为FeCl3·6H2O,B中溶液换为KSCN溶液,加热。 | A中固体部分变液态,产生白雾和黄色气体,B中KSCN溶液变红 |
(实验探究)实验操作和现象如下表:
(问题讨论)
(1)实验前首先要进行的操作是______________________________。
(2)实验1和实验2产生的白雾是_______(填化学式)溶解在水中形成的小液滴。
(3)请用离子方程式解释实验2中黄色气体使KI-淀粉溶液变蓝色的原因_____________。
(4)为确认黄色气体中含有Cl2,学习小组将实验1中试管B内KI-淀粉溶液替换为NaBr溶液,发现B中溶液呈橙色,经检验无Fe2+,说明黄色气体中含有Cl2。用铁氰化钾溶液检验Fe2+的离子方程式是_________________________________。选择NaBr溶液的原因是________________________________________________________________。
(实验结论)
(5)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为____________________________________________________。
(实验反思)
该学习小组认为实验1中溶液变蓝,也可能是酸性条件下,I-被空气氧化所致,可以先将装置中的空气排尽,以排除O2的干扰。
-
I.某研究性学习小组的同学决定通过实验对SO2的漂白作用到底是SO2本身还是SO2与水作用的产物导致的进行探究,他们查阅资料知:品红除了可以溶于水外,还可以溶于酒精中,也能形成红色溶液,且SO2不能与乙醇反应.经过研究,该小组设计了如图所示的装置,请根据实验目的回答以下问题.

(1)制取SO2时,一般选择80%左右的硫酸,而不宜选择98%的浓硫酸,原因是______,也不宜选择10%的硫酸,原因是______.
(2)装置B中应该装入的药品为______.
(3)该装置有一个明显的不足之处是______.
(4)按照完善后的装置完成实验,实验中控制S02以大约每分钟200个气泡的速率通过品红的酒精溶液,20分钟后溶液仍不褪色.由此可知,S02的漂白作用是______导致的.
Ⅱ.漂白仅是溶液褪色的原因之一,很多其它的化学反应也可以使某些有色溶液褪色,如:乙烯可使溴水和酸性KMnO4溶液褪色.某研究性学习小组发现:将SO2气体通入滴有酚酞试液的NaOH稀溶液中,也观察到溶液的红色褪去.该小组也想通过实验来探究该溶液褪色的原理,经过大家的讨论和分析后,提出了如下两种假设:
假设一:SO2或SO2与水作用的产物漂白了红色的酚酞试剂;
假设二:______.
请你设计一个简单合理的实验方案,验证以上哪种假设成立.______.
-
某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。通过查阅资料,学习小组获知:FeCl3是一种共价化合物,熔点306℃,沸点315℃。
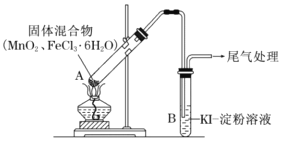
实验操作和现象:
| 操作 | 现象 |
| 点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
(1)现象i中的白雾是___________________,形成白雾的原因是________________。
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.直接加热FeCl3·6H2O,产生白雾和黄色气体。
b.将现象ii和a中的黄色气体通入KSCN溶液,溶液均变红。
通过该实验说明现象ii中黄色气体含有_______。
(3)除了氯气可使B中溶液变蓝外,该小组还提出其他两种可能的原因:
原因①:实验b检出的气体使之变蓝,反应的离子方程式是______________________________。
原因②:在酸性条件下,装置中的空气使之变蓝,反应的离子方程式是_______________。
(4)为进一步确认黄色气体中是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
| 方案1 | 在A、B间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
| 方案2 | 将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试荆是____________________。
②方案2中检验Fe2+的试剂是____________________。
③综合方案1、2的现象,说明方案2中选择NaBr溶液的依据是_____________________。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是_________________。
-
某实验小组同学对影响 CuSO4 溶液和浓氨水反应产物的因素进行了如下探究。
(查阅资料)
①Cu(OH)2(s) ⇌ Cu2+ + 2OH- Ksp = 2.2×10-20; ⇌Cu2+ + 4NH3 K = 4.8×10-14
⇌Cu2+ + 4NH3 K = 4.8×10-14
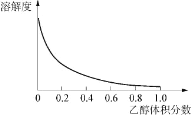
②Cu(NH3)4SO4·H2O 是一种易溶于水、难溶于乙醇的深蓝色固体, 加热分解有氨气放出。Cu(NH3)4SO4·H2O 在乙醇-水混合溶剂中的溶解度如下图所示。

(实验 1)CuSO4 溶液和浓氨水的反应。
| 序号 | 实验内容 | 实验现象 |
| 1-1 | 向 2 mL 0.1 mol/L CuSO4(pH=3.2)中逐滴加入 2 mL 1 mol/L 氨水 | 立即出现浅蓝色沉淀,溶液变无色; 随后沉淀逐渐溶解,溶液变为蓝色;最终得到澄清透明的深蓝色溶液 A |
| 1-2 | 向 2 mL 1 mol/L 氨水中逐滴加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 始终为澄清透明的深蓝色溶液 B |
(1)进一步实验证明,深蓝色溶液 A、B 中均含有 ,相应的实验方案为______________________(写出实验操作及现象)。
,相应的实验方案为______________________(写出实验操作及现象)。
(实验 2)探究影响 CuSO4 溶液和浓氨水反应产物的因素。
| 序号 | 实验内容 | 实验现象 |
| 2-1 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,溶液颜色变浅 |
| 2-2 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 1 mol/L NaOH | 有浅蓝色沉淀生成,上层清液接近无色 |
| 2-3 | 向 2 mL 0.1 mol/L 氨水中逐滴加入2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,上层清液接近无色 |
(2)依据实验 2-1,甲同学认为 Cu2+浓度是影响 CuSO4 溶液和浓氨水反应产物的因素之一。乙同学认为实验 2-1 没有排除硫酸铜溶液呈酸性的干扰,并设计了如下对比实验:
| 序号 | 实验内容 | 实验现象 |
| 2-4 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 试剂 a | 无明显现象 |
①用化学用语表示硫酸铜溶液呈酸性的原因:___________________________。
②试剂 a 为 ___________________________。
(3)利用平衡移动原理对实验 2-2 的现象进行解释:____________________________。
(4)实验 2-3 的目的是__________________________。
(5)综合上述实验可以推测, 影响 CuSO4 溶液和浓氨水反应产物的因素有________________________。
-
某实验小组同学对影响 CuSO4 溶液和浓氨水反应产物的因素进行了如下探究。
(查阅资料)
①Cu(OH)2(s) ⇌ Cu2+ + 2OH- Ksp = 2.2×10-20; ⇌Cu2+ + 4NH3 K = 4.8×10-14
⇌Cu2+ + 4NH3 K = 4.8×10-14
②Cu(NH3)4SO4·H2O 是一种易溶于水、难溶于乙醇的深蓝色固体, 加热分解有氨气放出。Cu(NH3)4SO4·H2O 在乙醇-水混合溶剂中的溶解度如下图所示。
(实验 1)CuSO4 溶液和浓氨水的反应。
| 序号 | 实验内容 | 实验现象 |
| 1-1 | 向 2 mL 0.1 mol/L CuSO4(pH=3.2)中逐滴加入 2 mL 1 mol/L 氨水 | 立即出现浅蓝色沉淀,溶液变无色; 随后沉淀逐渐溶解,溶液变为蓝色;最终得到澄清透明的深蓝色溶液 A |
| 1-2 | 向 2 mL 1 mol/L 氨水中逐滴加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 始终为澄清透明的深蓝色溶液 B |
(1)进一步实验证明,深蓝色溶液 A、B 中均含有 ,相应的实验方案为______________________(写出实验操作及现象)。
,相应的实验方案为______________________(写出实验操作及现象)。
(实验 2)探究影响 CuSO4 溶液和浓氨水反应产物的因素。
| 序号 | 实验内容 | 实验现象 |
| 2-1 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,溶液颜色变浅 |
| 2-2 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 1 mol/L NaOH | 有浅蓝色沉淀生成,上层清液接近无色 |
| 2-3 | 向 2 mL 0.1 mol/L 氨水中逐滴加入2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,上层清液接近无色 |
(2)依据实验 2-1,甲同学认为 Cu2+浓度是影响 CuSO4 溶液和浓氨水反应产物的因素之一。乙同学认为实验 2-1 没有排除硫酸铜溶液呈酸性的干扰,并设计了如下对比实验:
| 序号 | 实验内容 | 实验现象 |
| 2-4 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 试剂 a | 无明显现象 |
①用化学用语表示硫酸铜溶液呈酸性的原因:___________________________。
②试剂 a 为 ___________________________。
(3)利用平衡移动原理对实验 2-2 的现象进行解释:____________________________。
(4)实验 2-3 的目的是__________________________。
(5)综合上述实验可以推测, 影响 CuSO4 溶液和浓氨水反应产物的因素有________________________。
-
某化学小组对Na2SO3和AgNO3在不同pH下的反应及产物,进行了以下实验探究。
查阅资料:
Ⅰ.Ag2SO3:白色、难溶于水;
Ⅱ.Ag2O:棕黑色、难溶于水,易与酸溶液反应。
(1)根据资料:①通常情况Na2SO3溶液和AgNO3溶液反应产生的现象是________。
②若Ag2O与盐酸反应,其化学方程式应为___________。
(2)检测溶液pH:①0.1mol/LAgNO3溶液的pH=5,引发这一结果的微粒是________。
②0.1mol/LNa2SO3溶液的pH=10,其原因用离子方程式解释是________。
(3)实验探究:在不同pH条件下Na2SO3溶液与AgNO3溶液混合反应。
实验记录如下:

Ⅰ.实验a中沉淀溶解消失的原因,可能是___________。
Ⅱ.Ag2SO3在溶液中沉淀析出的大致pH范围是_________。
Ⅲ.将d中棕黑色絮状物X滤出、洗净、进行实验分析:
| 实验 | 操作 | 现象 |
| ⅰ | 将其置于试管中加稀盐酸、观察 | 无明显现象 |
| ⅱ | 将其置于试管中加足量浓硝酸、观察 | 立即产生红棕色气体 |
| ⅲ | 在ⅱ反应所得溶液中,加Ba(NO3) 2溶液、观察,再加BaCl2、观察 | 前者无明显现象,后者出现白色沉淀 |
①由实验ⅰ得出的结论是_________。
②d中的棕黑色絮状物X是_________。
③实验ⅱ中的化学反应方程式是___________。
(4)小组认为在酸性条件下,SO32-的________性增强,生成X的化学方程式是______。
-
化学小组探究FeCl3溶液与Na2S溶液的反应产物,利用图装置进行如下实验:
Ⅰ.向盛有0.1 mol•L-1FeCl3溶液的三颈瓶中,滴加一定量0.1 mol•L-1Na2S溶液,搅拌,能闻到臭鸡蛋气味,产生沉淀A。
Ⅱ.向盛有0.1 mol•L-1 Na2S溶液的三颈瓶中,滴加少量0.1mol•L-1 FeCl3溶液,搅拌,产生沉淀B。
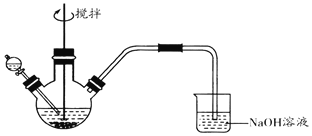
已知:①FeS2为黑色固体,且不溶于水和盐酸。②Ksp(Fe2S3)=1×10-88,Ksp(FeS2)=6.3×10-31,Ksp[Fe(OH)3]=1×10-38,Ksp(FeS)=4×10-19
回答下列问题:
(1)NaOH溶液的作用是______。
小组同学猜测,沉淀A、B可能为S、硫化物或它们的混合物。他们设计如下实验进行探究:
实验一、探究A的成分
取沉淀A于小烧杯中,进行如下实验:
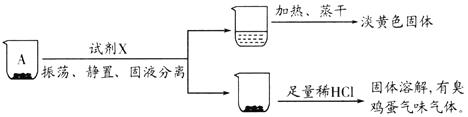
(2)试剂X是______。由此推断A的成分是______(填化学式)。
实验二、探究B的成分
取沉淀B于小烧杯中,进行如下实验:

(3)向试管a中加入试剂Y,观察到明显现象,证明溶液中存在Fe2+.试剂Y是______,明显现象是______。由此推断B的成分是______(填化学式)。
(4)请分析Ⅱ中实验未得到Fe(OH)3的原因是______。
-
某学习小组欲设计实验探究焦炭与二氧化硅反应的产物。
查阅资料:实验室可以用PdCl2溶液检验CO,二者发生反应会产生黑色金属钯,溶液变浑浊。
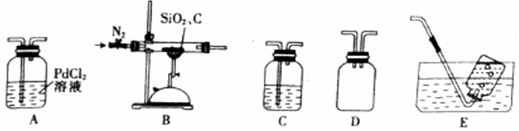
回答下列问题:
(1)上述装置连接顺序(按气流从左至右)为B→________→E。
(2)加热前,向装置内通入一段时间氮气,其目的是________;D装置的作用是________。
(3)若A中出现浑浊,写出A中发生反应的化学方程式________。
(4)C装置可用来检验CO2气体,可选用的试剂是________ (填字母)。
A.NaOH溶液 B.Ba(OH)2溶液
C.BaCl2溶液 D.品红溶液
(5)如果不用E装置,可能的后果是________。
(6)经测定B装置中生成的CO与CO2物质的量之比为2:1,写出B中发生反应的化学方程式________。












