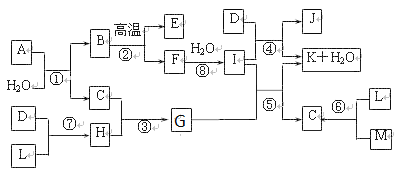
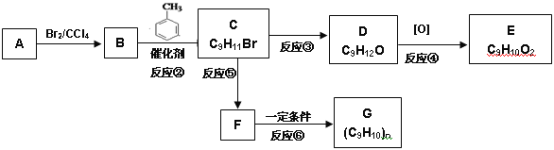
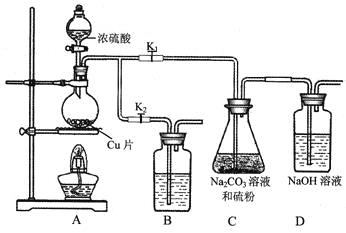
-
下列说法中不正确的有
①氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂;
②光照氯水有气泡逸出,该气体是Cl2;
③燃煤时加入适量石灰石,可减少废气中SO2的量;
④pH在5.6~7.0之间的降水通常称为酸雨;
⑤室温下浓硫酸与铜片不会发生剧烈的化学反应,原因是铜被钝化。
⑥氯气易液化,液氯可以保存在钢瓶中;
⑦常温下浓硫酸可以用铝制容器盛放;
⑧分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
A. 2个 B. 3个 C. 4个 D. 5个
难度: 中等查看答案及解析
-
2010年上海世博会将实现环保世博、生态世博目标,下列做法中不符合这一目标的是( )
A.部分国家的展馆使用可降解的建筑材料
B.把世博会期间产生的垃圾焚烧或深埋处理
C.某些馆的外壳使用非晶硅薄膜,以充分利用太阳能
D.停车场安装了催化光解设施,用于处理汽车尾气
难度: 简单查看答案及解析
-
下列说法不正确的是 ( )
①用润湿的pH试纸测定溶液的pH时,一定会产生误差
②明矾、胆矾、冰醋酸、硫酸钡、硫酸钠均为电解质
③某温度下测得纯水的c(H+)=2×10-7mol/L,则其中的c(OH-)=5×10-5mol/L
④所有的燃烧反应都为放热反应
A.仅有①④ B.仅有②③ C.仅有①③ D.全不正确
难度: 中等查看答案及解析
-
下列叙述正确的是
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.金属阳离子被还原后,一定得到该元素的单质
C.核外电子总数相同的原子,一定是同种元素的原子
D.需要加热才能发生的反应一定是吸热反应.
难度: 中等查看答案及解析
-
下列选项中,对于指定项目的数目前后相等的是 ( )
A.电子数:17gOH—与1mol-OH
B.双键数目:1mol
与4mol C2H4
C.分子数:常温常压下16g氧气与4g氦气
D.阴离子总数:72gCaO2与62g Na2O
难度: 中等查看答案及解析
-
下列叙述正确的是
A.48 g O3气体含有6.02×1023个O3分子
B.常温常压下,4.6 gNO2气体含有1.81×1023个NO2分子
C.0.5 mol·L-1L CuCl2溶液中含有3.01×1023个Cu2+
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2NA
难度: 中等查看答案及解析
-
在某澄清、透明的浅黄色溶液中,可能含有下列八种离子:H+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、S2-,在检验方案设计时初步分析其溶液中最多可含离子(只从这8种离子中选择)有( )
A.4种 B.5种 C.6种 D.7种
难度: 中等查看答案及解析
-
2005年10月12日,我国“神舟六号”载人飞船成功发射。航天飞船是用铝粉与高氯酸铵的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应: 2NH4ClO4 = N2↑+ 4H2O + Cl2 + 2O2↑;Δ H <0 下列对该反应的叙述中不正确的是 ( )
A.高氯酸铵的水溶液呈中性
B.每生成2 mol O2 ,反应中转移的电子数为14mol
C.该反应中Cl2是还原产物,N2和O2是氧化产物
D.该反应是焓减,墒增的反应,能自发进行
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 过量的SO2通入NaOH溶液中:SO2+ 2OH-=SO32-+H2O
B. Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2
C. NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
D. NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-
难度: 中等查看答案及解析
-
下列装置所示的实验中,能达到实验目的的是
A.
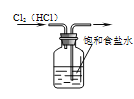 除去Cl2中的HCl杂质 B.
除去Cl2中的HCl杂质 B.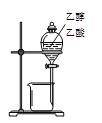 分离乙醇和乙酸
分离乙醇和乙酸C.
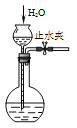 检查装置气密性 D.
检查装置气密性 D.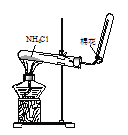 实验室制取NH3
实验室制取NH3难度: 中等查看答案及解析
-
某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是
A.若c(OH-)>c(H+),溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+)
B.溶液中不可能存在:c(Na+)>c (A-)>c(OH-)>c(H+)
C.若溶液中c(A-) = c(Na+),则溶液一定呈中性
D.若溶质为NaA、HA,则一定存在: c(A-)>c(Na+)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
下列是某学生自己总结的一些规律,其中正确的是 ( )
A.SO2通入品红溶液,溶液褪色后加热恢复原色;则SO2通入溴水,溴水褪色后加热也能恢复原色
B.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应
C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
D.同一种元素的各种同位素的化学性质不同
难度: 中等查看答案及解析
-
某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(
)如下表所示。下列说法正确的是
X
Y
W
(起始状态)/mol
2
1
0
(平衡状态)/mol
1
0.5
1.5
A.该温度下,此反应的平衡常数表达式是
B.升高温度,若W的体积分数减小,则此反应△H>0
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,再向容器中通入3 mol W,达到平衡时,
难度: 中等查看答案及解析
-
以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离【解析】
SO2(l)+SO2(l)SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是 ( )
A.该滴定反应可以表示为:SO32-+ SO2+=2SO2
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C.自离解的存在,说明SO2是离子化合物
D.可通过导电能力变化来判断是否到达滴定终点
难度: 中等查看答案及解析
-
某有机物是药物生产的中间体,其结构简式如图。下列有关叙述正确的是( )

A.该有机物与溴水发生加成反应
B.该有机物与浓硫酸混合加热可发生消去反应
C.1 mol该有机物与足量NaOH溶液反应最多消耗3 mol NaOH
D.该有机物经催化氧化后能发生银镜反应
难度: 中等查看答案及解析
-
由氧化铜和氧化铁的混合物ag,加入2 mol·L-1的硫酸溶液50 mL,恰好完全溶解,若将a g的该混合物在过量的CO气流中加热充分反应,冷却后剩余固体的质量为( )
A.1.6ag B.(a-1.6) g C.(a-3.2) g D.无法计算
难度: 中等查看答案及解析