-
下列说法正确的是( )
A.石油经过分馏及裂化等工序得到的物质均为纯净物
B.乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应
C.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
D.苯不能使酸性高锰酸钾溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
难度: 简单查看答案及解析
-
某温度下,水的离子积常数Kw=1×10-12。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
A.1∶10 B.9∶1 C.1∶9 D.99∶21
难度: 中等查看答案及解析
-
下列关于物质熔、沸点的比较正确的是( )
A. CCl4、MgCl2、Si3N4的熔点依次升高
B. Rb、K、Na、Li的沸点依次降低
C. 晶体硅、碳化硅、金刚石的熔点依次降低
D. HF、HCl、HBr的沸点依次升高
难度: 中等查看答案及解析
-
一种新催化剂,能在室温下催化空气氧化甲醛:HCHO+O2→CO2+H2O,该反应
A.反应物和生成物中都只含极性分子
B.反应物和生成物均为分子晶体
C.反应时有极性键和非极性键的断裂和它们的生成
D.产物中CO2 的键能大于H2O,所以沸点高于H2O
难度: 简单查看答案及解析
-
下列说法正确的有( )项:
(1)柠檬属于酸性食物(2)日照香炉生紫烟——碘的升华(3)若存在简单离子R2-,则R一定属于VIA族(4)青石棉(化学式为Na2Fe5Si8O22(OH)2),是一种硅酸盐产品,它含有一定量的石英晶体(5)“海沙危楼”是由于海沙带有腐蚀性,壶腐蚀混凝土中的钢筋等(6)用带橡皮塞的棕色试剂瓶存放浓HNO3
A.2项
B.3项
C.4项
D.5项
难度: 简单查看答案及解析
-
下列物质中,不属于合成材料的是
A. 塑料
B. 人造纤维
C. 合成橡胶
D. 黏合剂
难度: 简单查看答案及解析
-
对于下列金属的叙述不正确的是
A.在点燃镁、铝之前,应先用砂纸打磨,除去表面的氧化膜
B.用砂纸打磨的铝条,放在酒精灯上加热至熔化,铝会滴落下来
C.铁在氧气中燃烧生成的氧化物的主要成分是四氧化三铁
D.金属单质在自然界中多以化合态的形式存在,因为它们大多有较强的还原性
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.向明矾溶液中逐滴滴入Ba(OH)2溶液,至沉淀质量最大时反应为:2Al3+ + 3SO42- + 3Ba2+ + 6OH-= 3BaSO4↓+ 2Al(OH)3↓
B.在复盐NH4Fe(SO4)3溶液中逐滴加入少量Ba(OH)2溶液:2Fe2+ + SO42- + Ba2+ + 2OH-= BaSO4↓+ Fe(OH)2↓
C.向含0.2 molFeBr2的溶液中通入标准状况下3.36 L Cl2:4Fe2+ + 2Br- + 3Cl2 = 4Fe2+ + 6Cl- + Br2
D.向NaHSO4中滴入Ba(OH)2溶液至恰好显中性:H+ + SO42-+ Ba2+ + OH- = H2O + BaSO4↓
难度: 简单查看答案及解析
-
室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速度来滴定该浓氯水,根据测定结果绘制出ClO-、ClO3-等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是( )
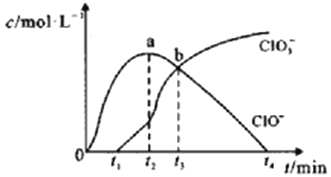
A.NaOH溶液和浓氯水可以使用同种滴定管盛装
B.a点溶液中存在如下关系:c(Na+) + c(H+) = c(ClO-)+ c(OH-)+ c(ClO3-)
C.b点溶液中各离子浓度:c(Na+) > c(Cl-) > c(ClO-) = c(ClO3-)
D.t2~t4,ClO-的物质的量下降的原因可能是ClO-自身歧化:2ClO-= Cl-+ ClO3-
难度: 简单查看答案及解析
-
常温常压下,将C12缓慢通入100 mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1 mol·L-1 NaOH溶液,整个过程溶液中H+的浓度变化如图所示。(已知常温常压下C12溶于水时,只有部分C12会和水发生反应)下列叙述正确的是
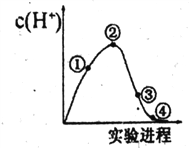
A.①处溶液的酸性比②处溶液的酸性强
B.依据②处c(H+)可计算溶解的C12的物质的量
C.整个实验过程中,溶液的颜色先变深后变浅,最后变为无色
D.④处表示C12与NaOH溶液恰好完全反应,共转移了0.1mol电子
难度: 中等查看答案及解析
-
将O2和NH3的混合气体448mL通过加热的三氧化二铬(催化剂),充分反应后,再通过足量的水,最终收集到44.8mL O2。原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )
A. 134.4mL B. 313.6mL C. 287.5mL D. 268.8mL
难度: 中等查看答案及解析
-
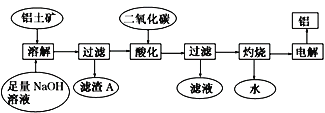
工业用
溶液吸收
,减少空气污染。常温下,测得
溶液吸收
过程中,pH随
的变化关系如下表所示,下列说法正确的是
pH
A.
B.
溶液的
,
C.吸收液的
时,

D.
溶液中,
的水解常数
难度: 困难查看答案及解析
-
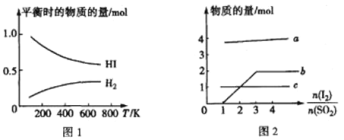
如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol
和2mol
,开始时容器的体积均为VL,发生如下反应并达到平衡状态
提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)
aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是
Ⅰ
Ⅱ
Ⅲ
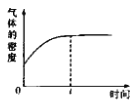
A.物质Z的化学计量数 a= 2
B.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
C.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
难度: 简单查看答案及解析
-
有机物 X(C4H6O5)广泛存在于许多水果内,尤以葡萄、西瓜、山渣内为多,X 的碳链结构无支链,分子式为 C4H6O5;1.34gX 与足量的钠溶液反应,生成标准状况下的气体 0.336L。X与醇或羧酸在浓 H2SO4 和加热的条件下均生成有香味的产物。X 在一定条件下可发生反应生成A,A
B
C(X、A、B、C 分子中碳原子数目相同)。下列有关说法中不正确的是( )
A.X 的结构简式为 HOOC—CHOH—CH2—COOH
B.A 的分子式为 C4H4O4
C.与 X的官能团种类、数量完全相同的同分异构体还有 3 种
D.C 物质能溶于水
难度: 中等查看答案及解析
-
对于苯乙烯
)的叙述有如下几点:
①能使酸性
溶液褪色;②可发生加聚反应;③可溶于水;④可溶于苯中;⑤能与浓硝酸发生取代反应;⑥所有的原子可能共平面。其中正确的是( )
A.
B.
C.
D.全部正确
难度: 中等查看答案及解析
-
“胃动力不够,请吗丁啉帮忙”是一句广告词,吗丁啉是一种常见的胃药,其有效成分的结构简式如下图所示。

下列关于该物质的说法中正确的是
A.该物质属于芳香烃
B.该物质的相对分子质量很大,属于高分子化合物
C.该物质可以发生水解反应和取代反应
D.该物质是一种蛋白质
难度: 中等查看答案及解析