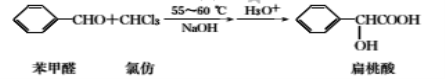-
化学与社会、生活密切相关。对下列现象或事实的解释错误的是( )
选项
现象或事实
解释
A
用铁罐贮存浓硝酸
常温下铁在浓硝酸中钝化
B
食盐能腐蚀铝制容器
Al能与Na+ 发生置换反应
C
用(NH4)2S2O8蚀刻铜制线路板
S2O82-的氧化性比Cu2+的强
D
漂白粉在空气中久置变质
Ca(ClO)2与CO2和H2O反应,生成的HClO分解
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法中不正确的是
A.10g质量分数为46%的乙醇水溶液中含有的氢原子总数为1.2NA
B.NA个P4(
)与NA个甲烷所含的共价键数目之比为1∶1
C.常温下,1 L pH=13的M(OH)2溶液中含有的OH-数目为0.1NA
D.含0.4 mol HNO3的浓硝酸与足量的铜反应,转移的电子数大于0.2NA
难度: 中等查看答案及解析
-
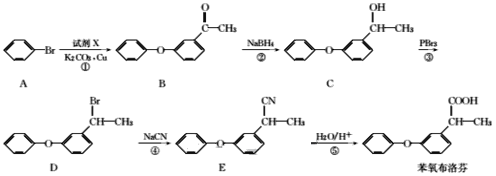
化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:
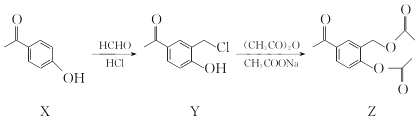
下列说法正确的是
A.X的分子式为C7H6O2 B.Y分子中的所有原子可能共平面
C.Z的一氯取代物有6种 D.Z能与稀硫酸发生水解反应
难度: 中等查看答案及解析
-
W、X、Y、Z为原子序数依次增大的四种短周期主族元素,四种元素的质子数之和为47,其中X、Y在周期表中位于同一主族,且Y原子核外电子数为X原子核外电子数的两倍。下列说法正确的是( )
A.X、Y与氢均可形成原子个数比为1:2的化合物
B.元素的最高正价:Z>X>W
C.最高价氧化物对应水化物的酸性:Y>Z
D.简单离子的半径:r(Z)>r(Y)>r(X)
难度: 中等查看答案及解析
-
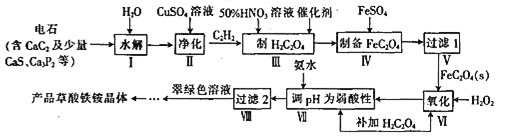
以PbO为原料回收铅的过程如下:
Ⅰ.将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbC14的溶液;
Ⅱ.电解Na2PbCl4溶液后生成Pb,原理如图所示。
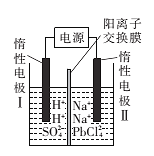
下列判断不正确的是
A.阳极区的溶质主要是H2SO4
B.电极Ⅱ的电极反应式为PbCl42—+2e—=Pb+4Cl—
C.当有2. 07 g Pb生成时,通过阳离子交换膜的阳离子为0.04 mol
D.电解过程中为了实现物质的循环利用,可向阴极区补充PbO
难度: 中等查看答案及解析
-
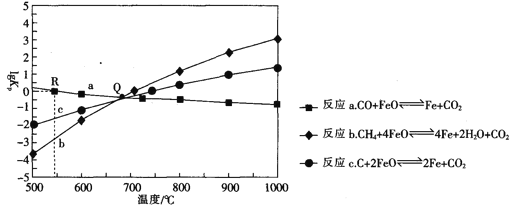
已知:AgSCN(白色,s)
Ag+(aq)+SCN-(aq),T℃时,Ksp(AgSCN)=1.0×10-12。在T℃时,向体积为20.00mL、浓度为mmol/L的AgNO3溶液中滴加0.l0mol/LKSCN溶液,溶液pAg的与加入的KSCN溶液体积的关系如图所示,下列说法错误的是( )
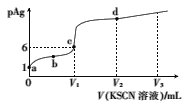
A.m=0.1
B.c点对应的KSCN溶液的体积为20.00mL
C.a、b、c、d点对应的溶液中水的电离程度:a>b>c>d
D.若V3=60mL,则反应后溶液的pAg=11-lg2
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是( )
选项
实验操作和现象
结论
A
向NaBr溶液中分别 滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色
Br-的还原性强于Cl-
B
相同条件下,分别 向20mL0.1mol/LKMnO4溶液和20mL0.5mol/LKMnO4溶液中滴加相同浓度和体积的草酸溶液(过量),0.5mol/LKMnO4溶液紫色褪去的时间更短(生成的Mn2+对该反应无影响)
浓度对反应速率的影响:浓度越大,反应速率越快
C
向淀粉碘化钾溶液中通入过量氯气,溶液由无色变为蓝色,后蓝色褪去
氯气具有强氧化性和漂白性
D
室温下,用pH试纸测得0.1mol/LNa2SO3溶液的pH约为10,0.1mol/LNaHSO3溶液的pH约为5
HSO3-结合H+的能力比SO32-的强
A.A B.B C.C D.D
难度: 中等查看答案及解析