-
“太阳能燃料”国际会议于2019年10月在我国武汉举行,旨在交流和探讨太阳能光催化分解水制氢、太阳能光催化二氧化碳转化为燃料等问题。下列说法错误的是( )
A.太阳能燃料属于一次能源
B.直接电催化CO2制取燃料时,燃料是阴极产物
C.用光催化分解水产生的H2是理想的绿色能源
D.研发和利用太阳能燃料,有利于经济的可持续发展
难度: 简单查看答案及解析
-
X、Y、Z、W为原子序数依次增大的短周期元素,它们位于两个主族。常温下,0.01mol∙L-1ZYX溶液的pH为12。下列相关说法正确的是( )
A.Z与W形成的化合物水溶液呈酸性
B.W的氧化物对应的水化物一定为强酸
C.由Y、Z、W三种元素形成的化合物不止两种
D.化合物X2Y、X2Y2中,Y不一定满足8电子结构
难度: 简单查看答案及解析
-
由下列实验及现象不能推出相应结论的是
选项
实验
现象
结论
A
将镁条点燃后迅速伸入集满N2的集气瓶中
集气瓶中有黄绿色粉末产生
氮气具有氧化性
B
将装有CuCl2·2H2O晶体的试管加热,在试管口放置湿润的蓝色石蕊试纸
试纸变为红色
CuCl2显酸性
C
将镁片和铝片分别打磨后,用导线连接,再插入NaOH溶液中
片刻后镁片上有大量气泡产生,铝片上产生的气泡很少
镁为电池正极
D
向2mLNa2S稀溶液中滴加0.1mol/LZnSO4溶液至不再有白色沉淀产生,然后再往上述溶液中滴加的0.1mol/LCuSO4溶液
沉淀由白色变为黑色
Ksp(ZnS)>Ksp(CuS)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列化学用语表示不正确的是
A.醛基:-COOH
B.乙烯的球棍模型:
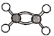
C.乙烯的结构简式:CH2=CH2
D.葡萄糖的分子式:C6H12O6
难度: 简单查看答案及解析
-
古代炼丹的五金通常是指金、银、铜、铁、锡。下列说法错误的是
A.用焦炭热还原SnO2可得到Sn B.用H2还原Fe2O3可得到Fe
C.Cu2S与过量O2共热产物中只含Cu D.Ag2O直接热分解可得到Ag
难度: 中等查看答案及解析
-
下列说法正确的是
A.灼热的炭与CO2的反应是放热反应
B.伴有能量变化的物质变化都是化学变化
C.通入大量的空气可以提高燃料燃烧时的能量利用率
D.化学反应过程中有物质的变化,同时又伴随有能量的变化
难度: 简单查看答案及解析
-
常温下,若CH3COONa和CH3COOH的混合溶液的pH>7,则下列关系式正确的是
A.c(CH3COO-)=c(Na+) B.c(CH3COO-)>c(Na+)
C.c(CH3COO-)<c(Na+) D.无法判断c(CH3COO—)与c(Na+)的大小
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A.Al(OH)3具有弱碱性,可用于治疗胃酸过多
B.浓硫酸具有脱水性,可用于干燥气体
C.SiO2能与碳反应,可用于制备光导纤维
D.苯酚容易被氧化,可用于制取酚醛树脂
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L-1 NaOH溶液:K+、Ca2+、SO32-、HCO3—
B.0.1 mol·L-1 FeCl3溶液:Na+、NH4+、SO42-、NO3—
C.0.1 mol·L-1 KI溶液:Al3+、Mg2+、ClO-、MnO4-
D.0.1 mol·L-1 H2SO4溶液:Cu2+、Ba2+、Cl-、AlO2-
难度: 中等查看答案及解析
-
某温度下,在恒容密闭容器中进行反应:X(g)+Y(g)
2(g)+W(s)。下列叙述正确的是
A.加入少量W,逆反应速率增大
B.当容器中Y的正反应速率与逆反应速率相等时,反应达到平衡
C.升高温度,正反应速率增大,逆反应速率减小
D.达到平衡后,X的转化率可能为100%
难度: 中等查看答案及解析
-
我国古代的青铜器工艺精湛,有很高的艺术价值和历史价值。下列说法不正确的是
A.我国使用青铜器的时间比使用铁器、铝器的时间均要早
B.将青铜器放在银质托盘上,青铜器容易生成铜绿
C.《本草纲日》中载有一药物,名“铜青”,铜青是铜器上的绿色物质,则铜青就是青铜
D.用蜂蜡做出铜器的蜡模,是古代青铜器的铸造方法之一,蜂蜡的主要成分是有机物
难度: 中等查看答案及解析
-
高铁酸钾是一种高效水处理剂,与水发生如下反应:4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2↑,下列有关说法正确的是
A.K2FeO4有强氧化性,故其可吸附水中的悬浮物
B.Fe(OH)3胶体有吸附性,对水有消毒杀菌作用
C.可用丁达尔效应检验上述反应是否发生
D.若生成22.4 L O2,转移电子数为4×6.02×1023
难度: 中等查看答案及解析
-
海水水资源的利用和海水化学资源的利用具有非常广阔的前景。下列有关叙述不正确的是
A.海带灼烧后的灰烬中碘元素以I2形式存在
B.从海水中制得的氯化钠可以用于生产漂白粉
C.以淡化后的浓海水为原料可以提高制溴的效益
D.淡化海水的方法有蒸馏法、电渗析法、离子交换法
难度: 中等查看答案及解析
-
课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橘子汁等物质来探究原电池的组成,下列结论不正确的是
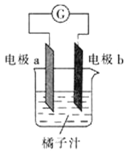
A.若a为铝片,b为锌片或铜片,则导线中一定产生电流
B.若a为锌片,b为铝片,则b极上的电极反应式为
C.原电池是将化学能转化为电能的装置
D.若a、b均为铝片,则电流计指针不偏转
难度: 简单查看答案及解析
-
用如图装置进行下列实验,最终试管内液体会分为上下两层的是

A.将过量SO2通入Br2水中
B.将过量SO2通入酸性KMnO4溶液中
C.将CH4与Cl2反应后产生的气体或蒸汽通入苯中
D.将含有乙醇、乙酸的乙酸乙酯蒸汽通入饱和Na2CO3溶液中
难度: 中等查看答案及解析
-
β一l,3一葡聚糖具有明显的抗肿瘤功效,受到日益广泛的关注。β-l,3一葡聚糖的结构简式如图,下列说法正确的是
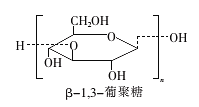
A.分子式为(C6Hl2O6)n B.与葡萄糖互为同系物
C.可以发生氧化反应 D.葡萄糖发生加聚反应可生成β-l,3一葡聚糖
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法中不正确的是
A.10g质量分数为46%的乙醇水溶液中含有的氢原子总数为1.2NA
B.NA个P4(
)与NA个甲烷所含的共价键数目之比为1∶1
C.常温下,1 L pH=13的M(OH)2溶液中含有的OH-数目为0.1NA
D.含0.4 mol HNO3的浓硝酸与足量的铜反应,转移的电子数大于0.2NA
难度: 中等查看答案及解析
-
分子式为C4H8O2且能与NaOH溶液反应的有机物有
A.2种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.浓盐酸与MnO2共热制取Cl2:MnO2+4H++2Cl—
Mn2++Cl2↑+2H2O
B.室温下用稀HNO3溶解铜:Cu+4H++NO3-=Cu2++NO↑+2H2O
C.室温下用足量氨水吸收少量SO2:NH3·H2O+SO2=NH4++HSO3-
D.室温下用稀盐酸溶解石灰石:CO32-+2H+=H2O+CO2↑
难度: 中等查看答案及解析
-
已知LiFePO4电池可用于电动汽车,电池反应式为FePO4+Li
LiFePO4,下列说法正确的是
A.电池充电时,Li作阳极
B.FePO4中磷元素被还原
C.电池放电时,氧化产物和还原产物的物质的量之比为1∶1
D.每消耗1 mol FePO4,必有2 mol电子转移
难度: 中等查看答案及解析
-
化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:
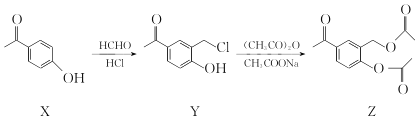
下列说法正确的是
A.X的分子式为C7H6O2 B.Y分子中的所有原子可能共平面
C.Z的一氯取代物有6种 D.Z能与稀硫酸发生水解反应
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A.Ca(ClO)2(aq)
HClO(aq)
O2(g)
B.Na(s)
Na2O2(s)
Na2CO3(s)
C.Fe(s)
FeCl3(aq)
FeCl3(aq)
D.S(s)
SO3(g)
H2SO4(aq)
难度: 中等查看答案及解析
-
已知25℃时,lgKa(CH3COOH)=lgKb(NH3·H2O)=-4.75。下列说法正确的是
A.0.1 mol·L-1 CH3COONH4溶液中:c(CH3COO-)=c(NH4+)=c(H+)=c(OH-)
B.0.1 mol·L-1 氨水与0.1 mol·L-1 NH4Cl溶液等体积混合:c(NH4+)+c(NH3·H2O)=2c(Cl-)
C.0.1 mol·L-1 CH3COONa溶液与0.1 mol·L-1 CH3COOH溶液等体积混合:c(CH3COOH)>c(Na+)>c(CH3COO-)
D.CH3COOH+NH3·H2O
CH3COO-+NH4++H2O的平衡常数为K,则lgK=9.5
难度: 中等查看答案及解析
-
复旦大学王永刚的研究团队制得一种柔性水系锌电池,该可充电电池以锌盐溶液作为电解液,其原理如图所示。下列说法不正确的是
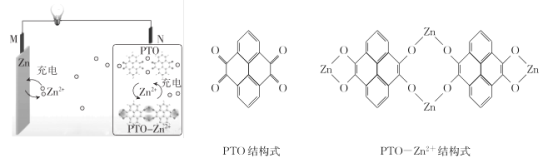
A.放电时,N极发生还原反应
B.充电时,Zn2+向M极移动
C.放电时,每生成1 mol PTO- Zn2+ ,M极溶解Zn的质量为260 g
D.充电时,N极的电极反应式为2PTO+8e- +4Zn2+=PTO- Zn2+
难度: 中等查看答案及解析
-
将浓度均为0.5mol∙L-1氨水和KOH溶液分别滴入到体积均为20mL且浓度相同的AlCl3溶液中,测得溶液的导电率与加入碱的体积关系如图所示,下列说法中错误的是( )
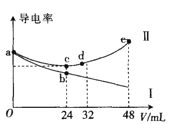
A.AlCl3溶液的物质的量浓度为0.2mol∙L-1
B.根据图象可以确定导电率与离子种类有关
C.cd段发生的反应是Al(OH)3+OH-=AlO2-+2H2O
D.e点时溶液中的离子浓度:c(K+) =c(Cl-) +c(AlO2-)
难度: 中等查看答案及解析
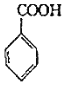 +COCl2→
+COCl2→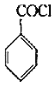 +CO2+HCl
+CO2+HCl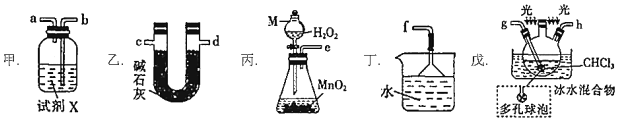

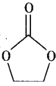 )是一种锂离子电池电解液的添加剂。
)是一种锂离子电池电解液的添加剂。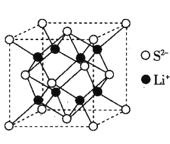
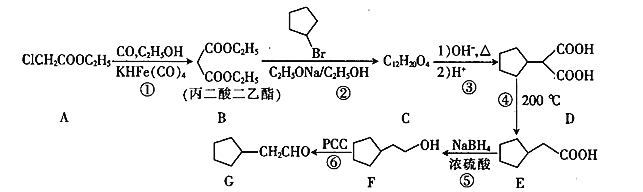
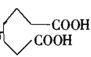 的合成路线(其他试剂任选)______________。
的合成路线(其他试剂任选)______________。