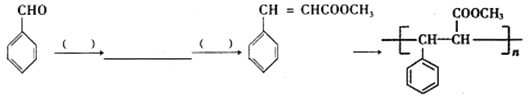
-
短周期主族元素W、X、Y、Z的原子序数依次增大,四种原子的最外层电子数之和为18,W与Y同主族,X原子的最外层电子数等于周期数,Z的单质在常温下为气体,下列说法正确的是
A.原子半径:Y>X>W
B.最简单氢化物的稳定性Z>W>Y
C.X与Z形成的化合物的水溶液能使红色石蕊试纸变蓝
D.Y的氧化物既能与碱反应,也能与酸反应・属于两性氧化物
难度: 中等查看答案及解析
-
化学与生产、生活及社会发展密切相关,下列有关说法不正确的是( )
A.“血液透析”和“静电除尘”利用了胶体的不同性质
B.氨基酸在人体中生成新的蛋白质的反应属于缩聚反应
C.棉花、蚕丝、腈纶均为天然纤维
D.在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮
难度: 简单查看答案及解析
-
下列设计的实验方案不能达到实验目的的是
A.检验亚硫酸钠溶液是否变质:取少量溶液,向其中加入硝酸酸化的硝酸钡溶液
B.制取乙酸乙酯:向试管中加入碎瓷片,再依次加入3mL乙醇、2mL浓硫酸和2mL乙酸,用酒精灯加热,将产生的蒸气经导管通到饱和碳酸钠钠溶液的上方
C.除去溴化钠溶液中混有的碘化钠:向溶液中加入稍过量溴水,充分反应后,加入四氯化碳,振荡后静置、分液,取上层溶液
D.探究温度对反应速率的影响:将2支均装有5mL 0.1mol·L−1硫代硫酸钠溶液的试管分别置于冰水和热水中,再同时向试管中加入5mL 0.1 mol·L−1稀硫酸
难度: 简单查看答案及解析
-
下列实验操作能达到实验目的的是( )
A. 加热使
升华,可除去铁粉中的
B. 电解氯化铝溶液,可制备铝单质
C. 加入烧碱溶液,充分振荡,静置,分液,可除去苯中的苯酚
D. 将氨水滴加到饱和
溶液中,可制备
胶体
难度: 中等查看答案及解析
-
下列关于有机物的叙述不正确的是
A.分子式为C4H8O2的酯有4种结构
B.主链含5个碳原子,有甲基、乙基2个支链的烷烃有3种
C.丙烯分子中最多有7个原子共平面
D.乙烯和溴的四氯化碳溶液反应生成1,2二溴乙烷
难度: 中等查看答案及解析
-
25 ℃时,将0.10 mol·L-1 CH3COOH溶液滴加到10 mL 0.10 mol·L-1 NaOH溶液中,lg
与pH的关系如图所示,C点坐标是(6,1.7)。下列说法不正确的是( )
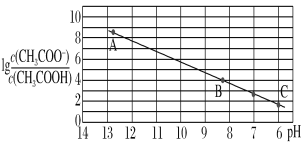
A. pH=7时加入的醋酸溶液的体积大于10 mL
B. C点后继续加入醋酸溶液,水的电离程度减小
C. B点存在c(Na+)-c(CH3COO-)=(10-6-10-8)mol·L-1
D. Ka(CH3COOH)=5.0×10-5
难度: 中等查看答案及解析
-
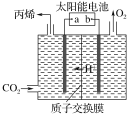
微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是
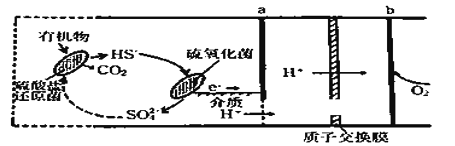
A.HS-在硫氧化菌作用下转化为SO42- 的反应为:HS-+4H2O-8e-== SO42-+9H+
B.电子从b流出,经外电路流向a
C.如果将反应物直接燃烧,能量的利用率不会变化
D.若该电池电路中有0.4mol 电子发生转移,则有0.45molH+通过质子交换膜
难度: 中等查看答案及解析
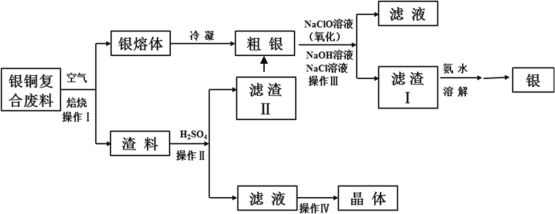
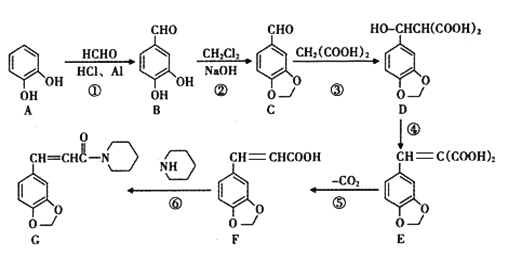
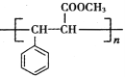 )的单体是薰衣草的调和香料,以苯甲醛(
)的单体是薰衣草的调和香料,以苯甲醛(