-
能正确表示下列反应的离子方程式是( )
A. 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑
B. 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
C. 将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-=Fe3++2H2O+NO↑
D. 将铜屑加入氯化铁溶液中:2Fe3++Cu=2Fe2++Cu2+
难度: 中等查看答案及解析
-
化学与人类生产、生活密切相关,下列说法正确的是( )
A. 蚕丝和棉花的组成元素相同,结构不同,因而性质不同
B. 硫酸亚铁片和维生素C同时服用,不能增强治疗缺铁性贫血的效果
C. 古代的陶瓷、砖瓦、现代的玻璃、水泥等都是硅酸盐产品
D. 工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属
难度: 简单查看答案及解析
-
下列分离物质的方法中,根据微粒大小分离的是( )
A. 萃取 B. 渗析 C. 蒸馏 D. 重结晶
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列说法不正确的是
A. 18gH2O中含有的电子数为10 NA
B. 46gNO2和46gN2O4含有的原子数均为3 NA
C. 1L 1mol·L-1的盐酸中,所含HCl分子数为NA
D. 标准状况下,11.2L O3中含1.5 NA个氧原子
难度: 中等查看答案及解析
-
下列各溶液中能大量共存的离子组是( )
A. 使酚酞试液呈红色的溶液中:CO32-、CH3COO-、SO42-、K+
B. 使pH试纸呈红色的溶液中:Fe2+、S2-、NO3-、Cl-
C. 使石蕊试液呈蓝色的溶液中:Mg2+、SO42-、Cl-、Ba2+
D. 使苯酚溶液呈紫色的溶液中:Na+、AlO2-、I-、SO32-
难度: 中等查看答案及解析
-
Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”.S2O32﹣和Cl2反应的产物之一为SO42﹣.下列说法不正确的是( )
A. 该反应中还原剂是S2O32﹣
B. H2O参与该反应,且作氧化剂
C. 根据该反应可判断氧化性:Cl2>SO42﹣
D. 上述反应中,每生成l mol SO42﹣,可脱去2mol Cl2
难度: 中等查看答案及解析
-
下列根据反应原理设计的应用,不正确的是
A. CO32-+H2O
HCO3-+OH-:用热的纯碱溶液清洗油污
B. A13++3H2O
Al(OH)3(胶体)+3H+:明矾净水
C. TiCl4+(x+2)H2O(过量)
TiO2·xH2O↓+4HCl:制备TiO2纳米粉
D. SnCl2+H2O
Sn( OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液
难度: 中等查看答案及解析
-
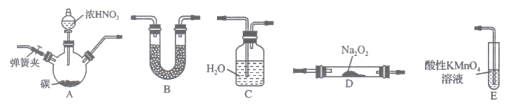
关于下列各装置图的叙述中正确的是( )

A. 装置①可用于实验室用制取氨气
B. 装置②中X若为四氯化碳,可用于吸收氨气
C. 装置③可用于制备氢氧化亚铁并观察其颜色
D. 装置④是原电池,锌电极为负极,发生还原反应
难度: 中等查看答案及解析
-
反应N2O4(g)
2NO2(g)ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. A、C两点气体的平均相对分子质量:A>C
D. 由状态B到状态A,可以用加热的方法
难度: 中等查看答案及解析
-
从下列实验事实中所得出的相应结论正确的是( )
实 验 事 实
结 论
A
常温下白磷可自燃,而氮气要在放电条件下才与氧气反应
非金属性:P>N
B
CO2的水溶液可导电
CO2是电解质
C
SO2通入溴水中,溶液褪色
SO2有漂白性
D
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀
同浓度溶液的pH:NaAlO2>NaHCO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
分子式为C9H12O属于芳香醇且苯环上有三个取代基的同分异构体共有( )
A. 4种 B. 5种 C. 6种 D. 8种
难度: 中等查看答案及解析
-
短周期主族元素X、Y、W、Z、R的原子序数依次增大.其中X、Z同主族,Z的单质是一种良好的半导体材料,W3+与Y2﹣具有相同的核外电子数,R是同周期中原子半径最小的元素.下列叙述正确的是( )
A. Y、Z形成的化合物为离子化合物
B. Y2﹣的离子半径大于W3+的离子半径
C. W的最高价氧化物对应的水化物的酸性比X的强
D. Z的气态简单氢化物的稳定性比R的强
难度: 中等查看答案及解析
-
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为
A. 9.0 L B. 13.5L C. 15.7 L D. 16.8 L
难度: 中等查看答案及解析
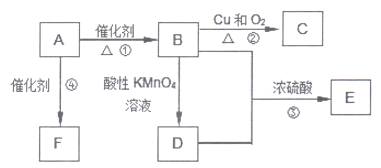

 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH