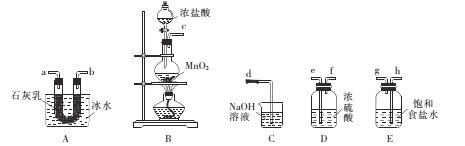
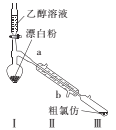
-
化学与生活、生产紧密相连,下列说法正确的是
A.粮食酿酒和制醋的过程中只发生水解反应
B.煤的干馏和石油的分馏原理相同
C.向牛奶中加入果汁会产生沉淀,这是因为发生了酸碱中和反应
D.食品包装袋中放置生石灰与放置硅胶的作用相同
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的数值。下列叙述正确的是
A.0.5 mol Mg在空气中完全燃烧生成MgO和Mg3N2时,转移的电子数为NA
B.7.8 g Na2O2与足量水反应时,转移的电子数为0.2NA
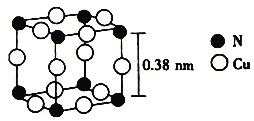
C.64 g CaC2固体中所含的阴、阳离子总数为3NA
D.密闭容器中充入1 mol H2与1 mol I2反应制备HI时,生成H-I键的数目为2NA
难度: 中等查看答案及解析
-
下列说法错误的是
A.淀粉、纤维素、蛋白质均为高分子
B.麦芽糖属于双糖,能发生银镜反应
C.油脂、氨基酸、蔗糖都能发生水解
D.通常情况下,强酸、强碱或高温条件均可使酶失去活性
难度: 简单查看答案及解析
-
下列实验操作不当的是
A.用标准盐酸来滴定氨水测定其浓度时,应选择甲基橙作指示剂
B.进行焰色反应时,用铜丝蘸取某碱金属盐溶液灼烧,观察火焰颜色
C.蒸发结晶过程中不断用玻璃棒搅拌液体至大部分晶体析出时停止加热
D.测定溶液pH时,用洁净的玻璃棒蘸取待测液滴在干燥pH试纸上,然后比色
难度: 中等查看答案及解析
-
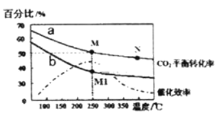
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为6;X 分别与W、Y形成的五原子分子均为正四面体结构;W与Y形成的化合物可腐蚀玻璃。下列说法正确的是
A.常温常压下X的常见单质为气态 B.W和Z形成的化合物ZW为离子化合物
C.Y与Z具有相同的最低化合价 D.原子半径:W<X<Y<Z
难度: 中等查看答案及解析
-
中国科学家用蘸墨汁书写后的纸张作空气电极(图1),设计并组装出一种轻型、能折叠的可充电锂空气电池,其工作原理如图2所示。下列有关说法正确的是
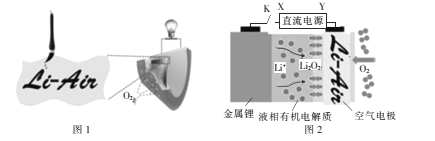
A.闭合开关K给锂电池充电,X为直流电源负极
B.放电时,纸张中的纤维素作锂电池的正极
C.放电时,Li+由正极经过液相有机电解质移向负极
D.充电时,阳极的电极反应式为Li2O2+2e -=O2↑+2Li+
难度: 中等查看答案及解析
-
25℃时,向20mL0.2mol·L-1NaCN溶液中加入0.2mol·L-1的盐酸,溶液pH随所加盐酸体积的变化如图所示(M>7)。下列说法不正确的是
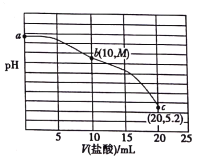
A.25℃时,K(HCN)≈10-9.4
B.b点时,c(CN-)<c(HCN)
C.c点时,c(Cl-)>c(H+)+c(HCN)
D.a、b、c三点时,水的电离程度:a>b>c
难度: 困难查看答案及解析