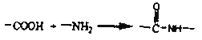-
化学与人类生产、生活、社会可持续发展等密切相关。下列说法正确的是
A. 河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以直接饮用
B. “低碳”是指采用含碳量低的烃类作为燃料
C. 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,其中CaO2属于碱性氧化物,过氧化苯甲酰属于有机物
D. 中国天眼FAST用到的碳化硅是一种新型无机非金属材料
难度: 简单查看答案及解析
-
2019年8月《Green Chemistry》报道了我国学者发明的低压高效电催化还原CO2的新方法,其总反应为NaCl+CO2
CO+NaClO。下列有关化学用语表示错误的是( )
A.中子数为12的钠原子:
Na B.Cl-的结构示意图:
C.CO2的结构式:O=C=O D.NaClO的电子式:
难度: 简单查看答案及解析
-
高铁酸钾(K2FeO4)是一种常用的水处理剂。工业制备高铁酸钾的离子方程式为:3C1O-+10OH-+2Fe3+═2FeO42-+3C1-+5H2O。下列相关叙述不合理的是( )
A.K2FeO4中铁元素的化合价是+6
B.制得1molK2FeO4转移3mole-
C.Fe3+的氧化性强于FeO42-的氧化性
D.氧化产物和还原产物物质的量之比为2:3
难度: 中等查看答案及解析
-
劣质洗发水中含有超标致癌物二噁烷
。关于该化合物的说法正确的是
A. 与
互为同系物 B. l mol二噁烷完全燃烧消耗5molO2
C. 一氯代物有4种 D. 分子中所有原子均处于同一平面
难度: 中等查看答案及解析
-
肼(N2H4)是火箭常用的高能燃料,常温下,为液体。一定条件,肼与双氧水可发生反应N2H4+2H2O2=N2↑+4H2O。用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2LN2中所含电子的总数为5NA
B.标准状况下,22.4LN2H4中所含原子的总数为6NA
C.标准状况下,3.2gN2H4中含有共价键的数目为0.6NA
D.若生成3.6gH2O,则上述反应中转移电子的数目为0.2NA
难度: 简单查看答案及解析
-
ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
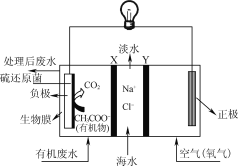
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
难度: 中等查看答案及解析
-
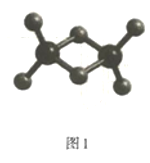
用0.100mol/LHCl溶液滴定0.100mol/LNa2CO3溶液的滴定曲线如图,已知f=
。下列说法错误的是
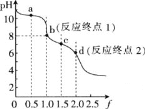
A.a点溶液中:c(HCO3-)>c(CO32-)
B.b点溶液中:c(Na+)>c(HCO3-)+c(CO32-)+c(H2CO3)
C.c点溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D.溶液中水的电离程度:a>b>c>d
难度: 中等查看答案及解析
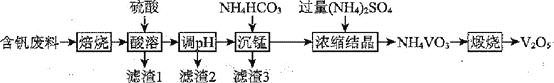
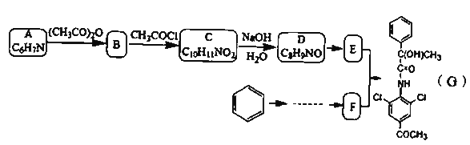
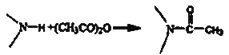 ;
;