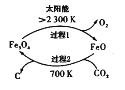
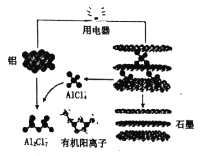
-
常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,该溶液可能是( )
①二氧化硫 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. σ键比π键重叠程度大,形成的共价键强
B. 两个原子之间形成共价键时,最多有一个σ键
C. 气体单质中,一定有σ键,可能有π键
D. N2分子中有一个σ键,2个π键
难度: 中等查看答案及解析
-
下列分子中,立体构型是平面三角形的是( )
A.CH4 B.NH3 C.BF3 D.CO2
难度: 简单查看答案及解析
-
A元素原子的各级电离能数据如下:

则元素A的常见价态是( )
A.+1 B.+2 C.+3 D.+6
难度: 简单查看答案及解析
-
下列电子排布图能表示氮原子的最低能暈状态的是( )
A.
 B.
B.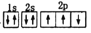
C.
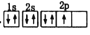 D.
D.
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.HF、HCl、HBr、HI的熔沸点依次升高
B.CH4、XC14都是含有极性键的非极性分子
C.H2O、CO2都是直线形分子
D.氯的各种含氧酸的酸性由强到弱排列为:HClO>HClO2>HClO3>HC1O4
难度: 简单查看答案及解析
-
在理论上不能用于设计原电池的化学反应是
A. NaCl(aq)+ AgNO3(aq)=AgCl(s)+ NaNO3(aq )△H<0
B. 2CH3OH(l) +3O2(g)=2CO2(g) + 4H2O (l)△H<0
C. 2FeCl3(aq)+Fe(s)=3FeCl3(aq) △H<0
D. 2H2(g) + O2 (g)=2H2O (l) △H<0
难度: 中等查看答案及解析
-
下列曲线表示卤素元素某种性质随核电荷数的变化趋势,正确的是
A.
B.
C.
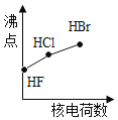 D.
D. 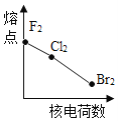
难度: 中等查看答案及解析
-
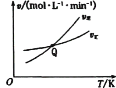
在一定条件下,X气体与Y气体反应生成Z气体。反应过程中,反应物与生成物的物质的量浓度随时间变化的曲线如图所示,则下列叙述正确的是( )
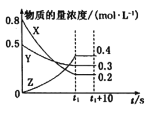
A.该反应的化学方程式为3X+Y=2Z
B.t1-(t1+10)s时,瞬时速度v(X)=v(Y)=0
C.0-t1s时反应物X的转化率为60%
D.0〜ls内X的反应速率为v(X)=
mol·L-1·s-1
难度: 中等查看答案及解析
-
现有四种元素的基态原子的电子排布式:①ls22s22p63s23p2 ②ls22s22p63s23p3 ③ls22s22p3 ④ls22s22p4。则下列有关比较中正确的是( )
A.原子半径:④>②>① B.电负性:④>③>②>①
C.第一电离能:④>③>②>① D.最高正化合价:④>③>②>①
难度: 中等查看答案及解析
-
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.第一电离能:Y小于X
B.气态氢化物的稳定性:HmY小于HnX
C.最高价含氧酸的酸性:X的强于Y的
D.X和Y形成化合物时,X显负价,Y显正价
难度: 简单查看答案及解析
-
氰气的化学式为(CN)2,结构式为N=C—C=N,性质与卤素相似。下列叙述正确的是( )
A.不和氢氧化钠溶液发生反应
B.分子中键的键长大于C≡C键的键长
C.分子中含有2个σ键和4个π键
D.分子中既有极性键,又有非极性键
难度: 中等查看答案及解析
-
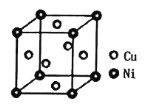
有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是
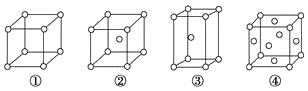
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
难度: 中等查看答案及解析
-
已知某些元素在周期表中的位置如图所示:
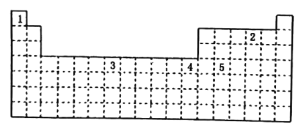
下列说法正确的是( )
A.表中五种元素位于5个不同的区
B.元素4的基态原子的价电子排布式为3d104s2与它具有相同最外层电子数的元素只可能处于ds区
C.元素1、2、3的基态原子中,未成对电子数之比为1:3:5
D.元素5的原子结构示意图为:
难度: 中等查看答案及解析
-
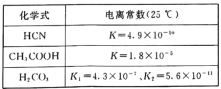
已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4溶液显酸性,关于NaHC2O4溶液中离子浓度关系的叙述不正确的是( )
A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4)
B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4)
C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-)
D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-)
难度: 简单查看答案及解析
-
关于下列装置说法正确的是( )
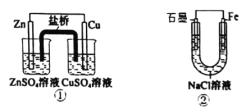
A.装置②中电子由Fe流向石墨,然后再经溶液流向Fe
B.装置①中,Zn为负极,发生还原反应
C.装置②中的Fe发生析氢腐浊
D.装置①中,盐桥中的K+移向CuSO4溶液
难度: 简单查看答案及解析
-
通常把原子总数和价电子总数相同的分子或离子称为等电子体,人们发现等电子体的空间结构相同,则下列有关说法中正确的是( )
A.CH4和NH4+是等电子体,键角均为60o
B.NO3-和CO32-是等电子体.均为平面三角形结构
C.H3O+和PC13是等电子体,均为三角锥形结构
D.N2和CO是等电子体,化学性质完全相同
难度: 简单查看答案及解析
-
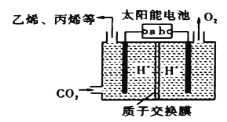
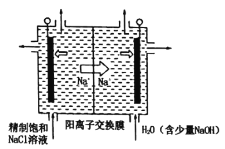
工业上可利用下图所示电解装置吸收和转化SO2(A、B均为惰性电极)。下列说法正确的是
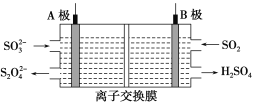
A.A电极接电源的正极
B.A极区溶液的碱性逐渐增强
C.本装置中使用的是阴离子交换膜
D.B极的电极反应式为SO2+2e-+2H2O ===
+4H+
难度: 简单查看答案及解析
-
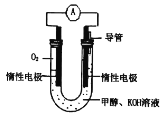
甲醛(
)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
A.甲醛分子间可以形成氢键
B.甲醛分子和甲醇分子内C原子均采取sp2杂化
C.甲醛为极性分子
D.甲醇的沸点远低于甲醛的沸点
难度: 简单查看答案及解析
-
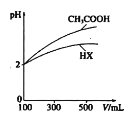
室温下,将0.1mol/L的一元酸HA溶液逐滴滴加到10mL0.1mol/LNaOH溶液中,pH的变化曲线如图所示。下列说法错误的是( )
A.一元酸HA为弱酸
B.a点所示溶液中c(Na+)>c(A-)>c(OH-)>c(HA)
C.pH=7时,c(Na+)>c(A-)+c(HA)
D.b点所示溶液中c(H+)-c(OH-)=1/2[c(A-)-c(HA)]
难度: 中等查看答案及解析