-
不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3以防止腐蚀。
(1)基态碳原子的电子排布图为___。
(2)铬和镍元素都易形成配位化合物:
①[Cr(H2O)4Cl2]Cl•2H2O中Cr3+的配位数为___。
②硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的立体构型是___,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为____。
③氨是___分子(填“极性”或“非极性”),中心原子的轨道杂化类型为___,氨的沸点高于PH3,原因是___。
(3)镍元素基态原子的价电子排布式为___,3d能级上的未成对电子数为___。
(4)单质铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为:ICu=1958kJ/mol、INi=1753kJ/mol,ICu>INi的原因是___。
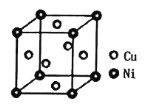
(5)某镍白铜合金的立方晶胞结构如图所示。若合金的密度为dg/cm3,晶胞参数a=___nm。
-
不锈钢是由铁、铬、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素.其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3防止腐蚀.
(1)写出Fe2+的基态离子的电子排布式:______;基态碳(C)原子的电子排布图为______
(2)[Cr(H2O)4Cl2]Cl•2H2O中Cr的配位数为______;已知CrO5中Cr为+6价,则CrO5的结构式为______.
(3)H2O的分子构型为______;H2O分子间能形成氢键的原因是______.
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞与面心立方晶胞中实际含有的Fe原子个数之比为______.

-
(11分)某合金由A、B、C、D 四种元素组成,这四种元素位于周期表中前四周期,A是主要成分元素,A的基态原子中有4个未成对电子。B是第一主要的合金元素,B的含量不低于11%,否则不能生成致密氧化膜BO3防止腐蚀,B与A同周期,且原子核外未成对电子数最多。C位于周期表中第4行、第10列,D的基态原子的最外层电子数是其电子层数的2倍,未成对电子数与电子层数相等。
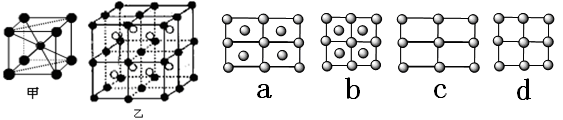
(1)A的原子结构示意图是________。A的一种晶体的晶胞如图甲,乙图中●和○表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到a~d图中正确的是________。
(2)写出B原子的基态的外围电子排布式_________________,与B同周期且基态原子最外层电子数与B相同的元素,可能位于周期表中的_ __区和 ___区。
(3)基态D原子的外围电子排布图是 。 据报道,只含镁、C和D三种元素的晶体竟然具有超导性。该晶体的结构(如图示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为________。晶体中每个 原子周围距离最近的
原子周围距离最近的 原子有________个。
原子有________个。

图中:●表示D原子, 表示C原子,
表示C原子, 表示镁原子
表示镁原子
(4)(已知 =1.414)CXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m。晶胞中两个C原子之间的最短距离为___________m(精确至0.01)。若晶体中的C分别为C2﹢、C3﹢,此晶体中C2﹢与C3﹢的最简整数比为_________。
=1.414)CXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m。晶胞中两个C原子之间的最短距离为___________m(精确至0.01)。若晶体中的C分别为C2﹢、C3﹢,此晶体中C2﹢与C3﹢的最简整数比为_________。
-
下列说法错误的是( )
A.所有不锈钢都只含有金属元素
B.镁合金的强度和硬度均高于纯镁
C.多数合金的熔点低于其组成成分金属的熔点
D.NO2在紫外线照射下,会发生一系列光化学反应,产生一种有毒的烟雾
-
下列有关合金的性质的说法正确的是
①合金与各成分金属相比较,具有许多优良的物理、化学或机械性能
②相同金属元素形成的合金、元素的含量有可能不同,但其性能是相同的
③镁铝合金在盐酸中不能完全溶解
④合金具有各成分金属性质之和
A. ①② B. ①③
C. ① D. ③④
-
下列有关合金性质的说法正确 的是
的是
A.合金与各成分金属相比较,具有许多优良的物理、化学或机械性能
B.相同金属元素形成的合金,元素的含量有可能不同,但其性能是相同的
C.镁铝合金在盐酸中不能完全溶解
D.合金具有各成分金属性质之和
-
下列说法正确的是( )
A. 所有不锈钢都只含有金属元素 B. 我国流通的硬币材质是金属单质
C. 生铁和钢是含碳量不同的两种铁碳合金 D. 镁合金的硬度低于纯镁
-
X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素。
(1)N元素在周期表中的位置是______,M的基态原子的价层电子排布图为_____。
(2)Y、D、E三种元素的电负性从大到小的排列顺序为________,第一电离能从大到小的排列顺序为_______。(均用元素符号表示)。
(3)由X、D两种元素按原子个数比为2:1组成的化合物,其中心原子的杂化方式为__________,该化合物属于___________分子(填“极性”或“非极性”)。
(4)金属镍粉在化合物YE气流中轻微加热,生成无色挥发性液态Ni(YE)4,呈四面体构型。423K时,Ni(YE)4分解为Ni和YE,从而制得高纯度的Ni粉。试推测:该液态物质易溶于下列______中(填字母)。
A.水 B.硫酸镍溶液 C.苯 D.四氯化碳
(5)某盐中含NE42-离子,是一种水处理剂,加入稀硫酸后快速生成黄色溶液并释放出一种无色无味的气体,请写出该反应的离子方程式___________________。
-
下列关于金属的说法不正确的是
A. 金属晶体由金属阳离子和自由电子构成
B.合金的熔点低于各成分金属
C.金属元素在不同化合物中化合价均不同
D.金属元素可以形成阳离子也可以形成阴离子
-
钢铁是铁碳合金的总称,其强度强,价格便宜,应用广泛,在以下关于不锈钢和普通钢的认识中正确的是 ( )。
A.它们的组成元素相同
B.耐腐蚀的性能相同
C.它们都属于钢但物理性质、内部结构和机械性能不同
D.构成普通钢和不锈钢的主要元素都是铁,因此化学性质完全相同



