-
列说法不正确的是( )
A.在船外壳镶嵌锌块保护船身,锌为原电池的负极
B.MgO的熔点高于NaCl,是因为MgO的晶格能大于NaCl
C.1molFeCl3完全水解将产生6.02×1023个胶体粒子
D.水的离子积常数Ksp随着温度的升高而增大,说明水的电离是吸热过程
难度: 中等查看答案及解析
-
下列基本实验操作中,不合理的是
A.分液操作时,分液漏斗下端管口尖端处紧靠烧杯内壁
B.可用湿润的pH试纸检验氨气
C.稀释浓硫酸时,可向盛有浓硫酸的烧杯中直接加蒸馏水
D.试管可用酒精灯直接加热,也可用水浴加热
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)
Na2CO3(s)
NaOH(aq)
B. Al(s)
NaAlO2(aq)
Al(OH)3(s)
C. AgNO3(aq)
[Ag(NH3)2]+(aq)
Ag(s)
D. Fe2O3(s)
Fe(s)
FeCl3(aq)
难度: 中等查看答案及解析
-
下列关于Na2O、Na2O2的比较,正确的是( )
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O2、Na2O都是可溶于水(或能与水反应)的白色固体
C.Na2O2在和CO2的反应中,既是氧化剂,又是还原剂
D.Na2O2与水反应时,1 mol Na2O2转移2 mol电子
难度: 简单查看答案及解析
-
下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )

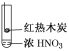
①
②
③
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
难度: 困难查看答案及解析
-
2016年IUPAC命名117号元素为Ts(中文名“
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是
难度: 简单查看答案及解析
-
在恒容密闭容器中通入X并发生反应:2X(g)
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是

A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,υ(Y)=
mol/(L·min)
C.M点的正反应速率υ正大于N点的逆反应速率υ逆
D.M点时再加入一定量的X,平衡后X的转化率减小
难度: 中等查看答案及解析


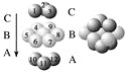

 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下: